Сомнологический кабинет
УНИВЕРСИТЕТСКОЙ КЛИНИЧЕСКОЙ БОЛЬНИЦЫ № 1ПЕРВОГО МОСКОВСКОГО ГОСУДАРСТВЕННОГО МЕДИЦИНСКОГО УНИВЕРСИТЕТА им. И. М. Сеченова
+7 (495) 178-01-04
+7 (915) 432-96-50
Заказать звонокТолько Москва и Моск. область
Синдром обструктивного апноэ во сне в клинике внутренних болезней. Пособие для врачей
1. ВВЕДЕНИЕ
Вероятно самое раннее из дошедших до нас упоминаний о человеке с нарушениями дыхания во время сна принадлежит древнеримскому ученому Элиану Клавдию. В одной из книг он рассказывает про Дионисия, правившего Гераклеей в эпоху Александра Македонского. Дионисий страдал столь выраженным ожирением, что даже дышал с трудом. Правитель так боялся задохнуться во сне, что приказал своим придворным медикам постоянно будить его уколами иглы.
Первое клиническое описание обструктивного апноэ во сне по всей видимости было сделано доктором W. H. Broadbent (1877). Хотя опубликованная им статья формально была посвящена дыханию Чейна‑Стокса при геморрагических инсультах, автор наблюдал дыхательный феномен, который сегодня мы однозначно можем опознать как обструктивные апноэ.
В дальнейшем в медицинской литературе периодически обсуждались пациенты, страдающие ожирением и дневной сонливостью, однако связь имеющейся симптоматики с нарушениями дыхания во время сна врачами не усматривалась. Наверное наиболее известным в этой связи является описанный C. S. Burwell с соавторами (1956) под названием “синдром Пиквика” случай хронической дыхательной недостаточности и дневной сонливости на фоне ожирения. И лишь спустя почти десять лет после этого, две независимые группы исследователей (H. Gastaut et al., 1965; R. Jung и W. Kuhlo, 1965) обнаружили у таких больных специфические вентиляционных нарушения во время сна, характеризующиеся повторными остановками дыхания, что и привело к формированию современной концепции СОАС.
2. КЛЮЧЕВЫЕ ПОНЯТИЯ, ОПРЕДЕЛЕНИЯ И КЛАССИФИКАЦИЯ
Храпом называют звук, возникающий в результате вибрации мягких тканей верхних дыхательных путей при дыхании во время сна; под первичным или неосложненным храпом понимают состояние при котором имеющий место звуковой феномен не сопровождается значимыми ограничениями воздушного дыхательного потока и нарушениями в структуре сна.
Апноэ – это дыхательная пауза во время сна, определяемая как отсутствие или значительное (более чем на 70% от исходного) уменьшение воздушного потока на уровне рта и носа, длительностью не менее 10 секунд; гипопноэ представляет собой уменьшение ороназального воздушного потока или амплитуды торакоабдоминальных дыхательных движений более чем на 30% по сравнению с исходными также в течение не менее чем 10 секунд и сопровождающееся снижением сатурации кислорода на 4% и более. Большинство респираторных эпизодов длится от 10 до 30 секунд, но иногда они могут продолжаться минуту и даже больше.
Выделяют три типа апноэ (гипопноэ): обструктивное, центральное и смешанное. Обструктивное апноэ вызывается закрытием верхних дыхательных путей во время вдоха, когда исчезновение ороназального потока происходит на фоне сохраняющихся дыхательных усилий (рис.1). Центральное связано с недостатком респираторных стимулов и проявляется одновременным отсутствием как ороназального потока, так и дыхательных движений. Смешанное апноэ представляет собой комбинацию двух предыдущих вариантов – начинаясь как центральное, оно в дальнейшем приобретает обструктивный характер, и на сегодняшний день считается частным случаем последнего.
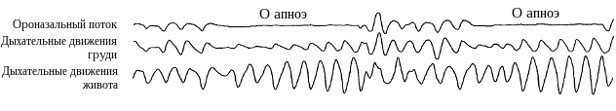
Рис. 1. Обструктивные апноэ. Исчезновение воздушного потока происходит на фоне сохраняющихся дыхательных движений живота и грудной клетки.
Эпизод обструктивного апноэ или гипопноэ обычно завершается реакцией активации. Под этим термином понимают транзиторное изменение в состоянии сна, проявляющееся кратковременным возрастанием мозговой активности которая более характерна для бодрствования, но в большинстве случаев не ведет к полному поведенческому пробуждению.
В ряде случаев частичная обструкция верхних дыхательных путей не приводит к значимому уменьшению легочной вентиляции и десатурации оксигемоглобина, но тем не менее оказывается достаточной, чтобы вызывать нарушения в структуре сна. Впервые такой вариант дыхательных расстройств был описан C. Guilleminault и соавторами (1993) и назван ими синдромом повышенного сопротивления верхних дыхательных путей. На сегодняшний день для обозначения данного респираторного феномена предложен другой термин – “активации, связанные с дыхательными усилиями”. Под этим понятием подразумеваются эпизоды, включающие уменьшение инспираторного воздушного потока, возрастающее дыхательное усилие и реакцию активации, но не подпадающие под критерии апноэ или гипопноэ.
 Иллюстрация 1. Спящий слуга Джо из романа Ч. Диккенса | Синдром обструктивного апноэ во сне (СОАС) характеризуется повторными эпизодами обструкции верхних дыхательных путей, которые вызывают нарушение нормальной структуры сна и часто сопровождаются снижением насыщения крови кислородом. В соответствии с последней редакцией Международной классификации расстройств сна (2005) синдром повышенной сопротивляемости верхних дыхательных путей предлагается рассматривают как частный случай проявления СОАС. Термин “синдром Пиквика” относится к числу достаточно широко используемых во врачебной практике. Под этим названием C. S. Burwell с соавторами (1956) описали больного с признаками хронического легочного сердца, дыхательной недостаточностью, полицитемией, дневной сонливостью и избыточным весом. Исследователи посчитали, что причиной наблюдавшихся ими расстройств является хроническая альвеолярная гиповентиляция на фоне выраженного ожирения1 и именно такое понимание данного патологического состояния закреплено в Международной статистической классификации болезней (МКБ‑10). |
Однако, так как обструктивные нарушения дыхания во время сна первоначально были описаны именно у больных с “синдромом Пиквика”, эти понятия во врачебном сознании стали часто ассоциироваться друг с другом. Более того, столь живо изображенный Чарльзом Диккенсом все время засыпающий храпун и толстяк Джо, который послужил прототипом для авторов “Пиквикского синдрома”, судя по описанию страдал именно СОАС, т.е. с позиций современной классификации болезней, как ни парадоксально это прозвучит, “пиквиком” вероятно не являлся. В результате разные авторы до настоящего времени вкладывают в это название свой собственный смысл, что регулярно приводит к возникновению терминологической путаницы. Таким образом, на наш взгляд термин “синдром Пиквика” представляет скорее исторический интерес и его следует по возможности исключить из употребления.
Выраженность возникающих дыхательных расстройств оценивают на основании индекса апноэ‑гипопноэ, который определяется как среднее число эпизодов апноэ и гипопноэ, или на основании индекса дыхательных расстройств, который отражает среднее число всех обструктивных респираторных событий за час сна. Так как синдром повышенной сопротивляемости верхних дыхательных путей стали рассматривать в качестве одной из составляющих СОАС сравнительно недавно, многие актуальные на сегодняшний день руководства все еще предлагают в практической врачебной деятельности ориентироваться на индекс апноэ‑гипопноэ.
Кроме того для характеристики сопутствующих нарушений оксигенации иногда используется индекс десатурации, рассчитываемый как среднее число падений сатурации кислорода на 4% и более от исходной за час сна.
Существуют определенные противоречия в вопросе о том, наличие какого числа респираторных эпизодов является основанием для постановки диагноза СОАС. Наиболее часто встречающееся в последние годы в литературе количественное определение соответствует индексу апноэ‑гипопноэ (или индексу дыхательных расстройств) больше 5. В тоже время есть мнение, что необходимо дифференцировать “истинный” СОАС с характерной клинической картиной и обструктивные апноэ во сне в виде бессимптомной инструментальной находки.
Компромиссное решение, объединяющее количественные и качественные признаки, нашло отражение в диагностических критериях СОАС (табл.1), предлагаемых в Международной классификации расстройств сна (2005).
Таблица 1. Диагностические критерии СОАС
- Присутствует хотя бы один симптом из перечисленных ниже:
- Спонтанные засыпания, дневная сонливость, инсомния, неосвежающий сон, чувство усталости в течение дня.
- Пробуждения с ощущением задержки дыхания, нехватки воздуха или удушья.
- Громкий храп и/или прерывистое дыхание во время сна.
При инструментальном исследовании выявляются:
- Пять и более любых респираторных эпизодов обструктивного характера, или
- Пятнадцать и более любых респираторных эпизодов обструктивного характера за час сна.
- Имеющая место симптоматика не связана с другими заболеванием и не обусловлена применением лекарственных препаратов или психоактивных веществ.
Для постановки диагноза СОАС необходимо наличие критериев А, B и D или C и D.
На сегодняшний не существует общепринятой классификации СОАС по тяжести течения. Существующие классификации основываются на результатах отдельных клинических исследований или отражают мнение различных экспертных групп. В результате между ними существуют достаточно существенные расхождения. Ниже представлен рабочий вариант, являющийся результатом обобщения на основании нашего собственного клинического опыта ряда существующих на сегодняшний день классификаций. Он не претендует на всеобъемлющий характер, мы лишь постарались адаптировать имеющиеся в литературе наработки к использованию в повседневной общеклинической практике (табл.2).
Таблица 2. Классификация СОАС по тяжести течения.
(От автора: На момент написания данной работы все сказанное про оценку тяжести сонного апноэ было справедливо, но на сегодняшний день существует другая общепризнанная специалистами классификация СОАС по тяжести течения, которая отличается от приводимой ниже. С актуальной классификацией вы можете ознакомиться в моих более поздних публикациях).
- ЛЕГКОЕ ТЕЧЕНИЕ: Дневная сонливость выражена минимально. Эпизоды апноэ и гипопноэ не сопровождаются значимой гипоксемией или сердечно‑сосудистыми нарушениями. Индекс дыхательных расстройств меньше 20 эпизодов в час.
- СРЕДНЕТЯЖЕЛОЕ ТЕЧЕНИЕ: Дневная сонливость выражена, но преимущественно беспокоит пациента вне активной деятельности. Эпизоды апноэ и гипопноэ вызывают выраженную гипоксемию и клинически значимые нарушения сердечного ритма. Отсутствует адекватное снижение артериального давления во время сна. Индекс дыхательных расстройств 20 и более, но меньше 40 эпизодов в час.
- ТЯЖЕЛОЕ ТЕЧЕНИЕ: Постоянная дневная сонливость, нарушающая нормальную жизнедеятельность пациента. Эпизоды апноэ и гипопноэ сопровождаются тяжелой гипоксемией и угрожающими нарушениями ритма сердца. Отмечается повышение артериального давления во время сна. Возникают ночные приступы стенокардии. Могут присутствовать хроническая дыхательная и правосердечная недостаточность. Индекс дыхательных расстройств 40 и более эпизодов в час.
3. СОН ЧЕЛОВЕКА В НОРМЕ И У ПАЦИЕНТОВ С СОАС
Сон представляет собой особое физиологическое состояние организма в основе которого лежат специфические изменения активности головного мозга и характеризующееся определенной цикличностью происходящих в это время процессов. Это сложное явление механизмы и функции которого еще недостаточно изучены. Он состоит из двух основных частей, получивших название NREM‑сна или сна без быстрого движения глаз и REM‑сна или сна с быстрым движением глаз2. В структуре NREM‑сна выделяют 4 стадии. Первая, самая короткая, рассматривается как переход от бодрствования ко сну. Вторая представляет собой установившийся сон и является наиболее продолжительной. Третья и четвертая стадии – это глубокий, так называемый медленноволновой сон. Основной функцией NREM‑сна считается восстановительная. Его можно кратко охарактеризовать как период относительного торможения мозговой активности при пониженном, но сохраненном мышечном тонусе. Продолжительность NREM‑сна обычно составляет 75‑80% от общего времени сна.
REM‑сон по своим характеристикам существенно отличается от NREM‑сна. Энцефалограмма в это время напоминает картину бодрствования, появляются специфические движения глазных яблок, наблюдается вегетативная активация с дыхательной и сердечной аритмией, колебаниями артериального давления, эрекцией. При этом скелетная мускулатура, напротив, оказывается максимально расслабленной. Именно после пробуждения во время REM‑сна люди наиболее часто рассказывают о своих сновидениях. REM‑сон рассматривается как важная составляющая механизмов переработки информации и психической защиты. Его можно охарактеризовать как период высокой мозговой активности в сочетании с мышечной атонией. У здоровых взрослых людей REM‑сон представлен 4‑6 отдельными эпизодами и его продолжительность обычно составляет порядка 20‑25% от общего времени сна.
Стадии NREM‑сна и REM‑сон несколько раз последовательно сменяют друг друга. Каждый такой цикл в среднем занимает около 90 минут. При этом глубокие стадии NREM‑сна в большей степени представлены в первую половину ночи, а REM‑сон – во вторую (рис.2).
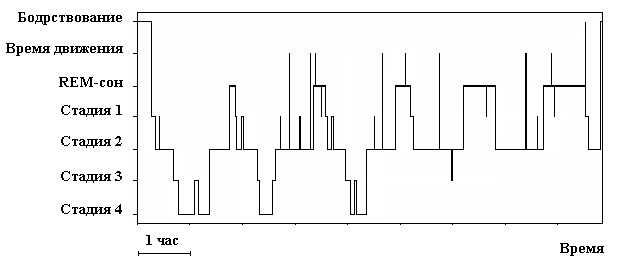
Рис. 2. Гистограмма сна здорового взрослого человека (пояснения в тексте).
Возникающие у пациентов с СОАС нарушения сна носят не только количественный, но и качественный характер. Общее время сна обычно уменьшается незначительно. Однако, связанные с обструкцией верхних дыхательных путей реакции активации приводят к грубым нарушениям в структуре сна (рис.3), делая его поверхностным и фрагментированным. Представленность 1 стадии NREM‑сна заметно возрастает, а продолжительность 3‑й и 4‑й стадий NREM‑сна и REM‑сна, напротив, существенно уменьшается.
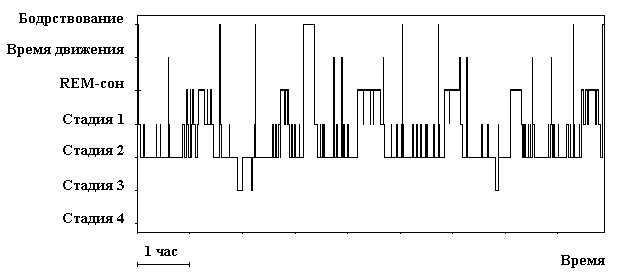
Рис. 3. Гистограмма сна больного с СОАС. Время засыпания укорочено. Сон прерывистый. Преобладают часто сменяющие друг друга 1‑ая и 2‑я стадии NREM‑сна при практически полном отсутствии медленноволнового сна. Продолжительность REM‑сна также уменьшена.
4. ЭПИДЕМИОЛОГИЯ
СОАС относится к числу наиболее распространенных патологических состояний и может встречаться в любом возрасте с детских лет до старости. Однако результаты, полученные в ходе различных эпидемиологических исследований, значительно варьируют в зависимости от характера обследованной популяции и использованных диагностических критериев. Обобщая имеющиеся в литературе данные можно заключить, что от 2% до 5% лиц в возрастной категории от 30 до 60 лет страдают СОАС. По данным этих же авторов вероятность возникновения СОАС возрастает пропорционально возрасту и весу обследуемых. Кроме того обструктивные нарушения дыхания во время сна у мужчин среднего возраста наблюдаются приблизительно в 2‑3 раза чаще, чем у женщин.
Длительное время считалось, что наиболее часто СОАС выявляется у мужчин среднего возраста с избыточным весом. Однако в последние годы рядом исследователей было показано, что обструктивные нарушения дыхания во время сна встречаются у пожилых в среднем в 3 раза чаще по сравнению с более молодыми (рис.4). Кроме того в старшей возрастной группе наличие СОАС гораздо в меньшей степени зависит от пола, возраста и веса, сопровождается минимальной симптоматикой и не приводит, по крайней мере столь явно, как у пациентов среднего возраста, к различным сердечно‑сосудистым осложнениям.
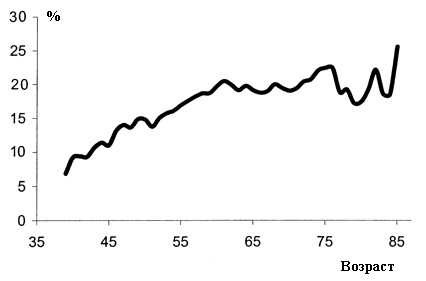
Рис. 4. Количество пациентов с СОАС (индекс апноэ‑гипопноэ >15) в популяции в зависимости от возраста по результатам Sleep Heart Health Study (T. Young et al., 2002).
Основываясь на анализе распространенности и клинические проявления СОАС в различных возрастных группах D. L. Bliwise (2000) высказал предположение о наличии двух существенно различающихся типов пациентов с обструктивными нарушениями дыхания во время сна.
Первый тип – это больные с рано возникшим СОАС. Им свойственны выраженное ожирение и значительные нарушения дыхания во время сна, сопровождающиеся яркой клинической симптоматикой и приводящие к разнообразным сердечно‑сосудистым нарушениям. Такие пациенты активно предъявляют жалобы, большинству из них требуется интенсивное лечение и поэтому они оказываются в поле зрения врачей. Именно такой тип дыхательных расстройств чаще всего встречается в возрасте от 40 до 60 лет, что и сформировало мнение о наибольшей распространенности СОАС в данной возрастной группе. В дальнейшем подобные больные попадаются все реже, что может объясняться их высокой смертностью от сердечно‑сосудистой патологии, о чем будем говориться ниже.
Ко второму типу относятся пациенты, приобретшие СОАС в более позднем возрасте. Их отличают умеренный избыток веса, сравнительно легкие нарушения дыхания во время сна и скудная клиническая симптоматика. Число таких больных прогрессирующе увеличивается с возрастом. Клиническая значимость расстройств дыхания во время сна и необходимость их лечения у данной категории пациентов до настоящего времени дискутируются. Не исключено, что в будущем представления о нормальном дыхании во сне для пожилых будут пересмотрены.
Отдельно следует подчеркнуть, в целой серии исследований было показано наличие обструктивных нарушений дыхания во время сна у 20‑40% больных с артериальной гипертонией, хронической ишемической болезнью сердца, с инфарктом миокарда и инсультом в анамнезе, т.е. у значительной части контингента, обычного для клиники внутренних болезней.
По нашим данным около трети больных, находящихся на лечении в отечественных терапевтических стационарах, страдают СОАС, что значительно выше чем в общей популяции. Однако эта патология все еще недостаточно знакома широкому кругу отечественных практических врачей. Показательно, что до настоящего времени в диагнозах лечебных учреждений, направляющих больных для стационарного лечения, обструктивные нарушения дыхания во время сна практически никогда не упоминаются, несмотря на то, что наличие СОАС во многих случаях может быть с высокой вероятностью предположено еще на догоспитальном этапе.
5. СОАС И ЛЕТАЛЬНОСТЬ
Наличие СОАС неблагоприятно сказывается на состоянии здоровья и продолжительности жизни больных. Так J. He с соавторами (1988) показали, что в подгруппе пациентов с индексом апноэ превышающим 20 смертность была достоверно выше по сравнении с подгруппой больных с индексом апноэ менее 20 (рис. 5‑А). При этом за весь период наблюдения не умер ни один из пациентов, получавших адекватное лечение СОАС
(рис. 5‑Б).
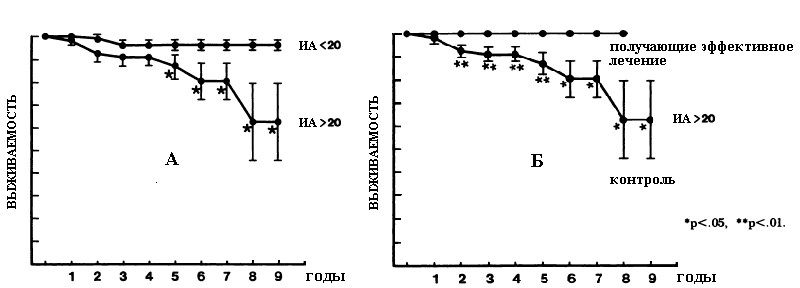
Рис. 5. Зависимость показателей смертности больных с СОАС от исходной тяжести (А) и эффективности лечения (Б) обструктивных нарушений дыхания во время сна
(He J. et al., 1988).
M. Patrinen с соавторами (1988) изучали летальность у больных с СОАС, которым было рекомендовано только снижение веса тела, в сравнении с пациентами, у которых были устранены обструктивные нарушения дыхания во время сна. За пятилетний период наблюдения летальность в первой группе составила 11%, в то время как среди больных, у которых СОАС сразу же был эффективно скорректирован, не умер никто. Преобладала летальность, обусловленная сердечно‑сосудистой патологией, причем большинство смертей наступило во сне.
M. J. Thorpy и соавторы (1990), проанализировав причины и время летальных исходов у пациентов с СОАС, установили, что в 71% случаев их смерть была вызвана кардиоваскулярными проблемами, и почти у половины из них наступила в ночные часы.
J. M. Marin и соавторы (2005) показали, что при наличии тяжелого СОАС вероятность возникновения сердечно‑сосудистых осложнений, в том числе приводящих к смертельному исходу, возрастает в 3 раза, тогда как при адекватном лечение обструктивных нарушений дыхания во сне риск становится аналогичным таковому в группе здоровых лиц.
Таким образом, большинство исследователей сходятся во мнении, что обструктивные нарушения дыхания во время сна существенным образом сказываются на продолжительности жизни этих больных и основной причиной, приводящей к повышенной смертности у пациентов с СОАС, являтся раннее возникновение и быстрое прогрессирование сердечно‑сосудистой патологии.
6. МЕХАНИЗМЫ ВОЗНИКНОВЕНИЯ И ПРЕДРАСПОЛАГАЮЩИЕ ФАКТОРЫ
Проходимость верхних дыхательных путей обеспечивается за счет поддержания равновесия между активностью мышц, отвечающих за расширение верхних дыхательных путей, и отрицательным давлением, генерирующимся в просвете дыхательных путей во время вдоха. После засыпания мышечный тонус понижается, что у предрасположенных лиц создает условия для вибрации стенок глотки при дыхании, внешне проявляющейся храпом. Периодически амплитуда этих колебаний оказывается столь велика, что происходит частичное или даже полное смыкание стенок верхних дыхательных путей, создавая значимое препятствие респираторному потоку при сохраняющихся дыхательных движениях (рис.6).
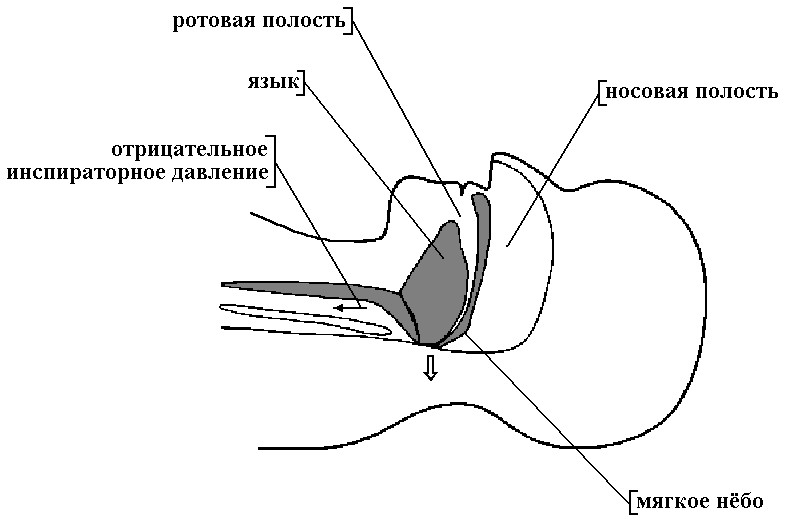
Рис. 6. Механизм возникновения обструктивного апноэ: в процессе вдоха генерируется отрицательное давление, которое провоцирует коллапс верхних дыхательных путей на уровне рото‑ и гортаноглотки.
Кроме того показано, что предрасположенность к глоточному коллапсу наблюдается не только во время вдоха, но и в самом конце выдоха, когда падает активность мышц, поддерживающих верхние дыхательные пути в открытом состоянии, а давление в них становится близким к атмосферному.
Так как способность верхних дыхательных путей к спадению напрямую связана со степенью мышечной гипотонии, наиболее выраженные обструктивные нарушения дыхания обычно ассоциированы с REM‑сном. Возникающие при этом респираторные события более длительные и сопровождаются более тяжелой гипоксемией, а у части пациентов вообще возникают только во время REM‑сна.
Возрастающие дыхательные усилия, гипоксия и гиперкапния приводят к возникновению реакции активации. “Микропробуждение” позволяет повысить тонус фарингеальных мышц и восстановить проходимость верхних дыхательных путей. После нормализации пассажа воздуха сон углубляется, мышечный тонус вновь падает и описанный процесс повторяется.
Исходя из вышесказанного, к возникновению СОАС предрасполагает любое состояние, приводящие к уменьшению просвета верхних дыхательных путей или понижению мышечного тонуса.
Одним из основных факторов риска СОАС является избыточная масса тела. На момент обращения к врачу две трети пациентов страдают от ожирения. Наблюдается прямая зависимость между степенью ожирения, риском возникновения СОАС и тяжестью дыхательных расстройств во время сна. При этом ведущая роль принадлежит отложениям жира в области глотки, так что окружность шеи является более значимым предиктором СОАС, чем индекс массы тела. Однако поскольку обструктивные нарушения дыхания во время сна не только чаще встречается, но и прогрессируют с возрастом, некоторые больные сообщают, что в прошлом симптомы болезни у них были менее заметны, несмотря на то что вес мог быть и больше. Кроме того, на практике часто встречается сочетание ожирения и других факторов риска.
Как уже упоминалось выше, СОАС в большей степени мужское, чем женское заболевание. Полагают, что такое различие в первую очередь обусловлено влиянием половых гормонов. В пользу этого свидетельствует тот факт, что у женщин в менопаузе СОАС встречается почти также часто, как у мужчин, а назначение им заместительной гормональной терапии сопровождается уменьшением тяжести дыхательных расстройств во время сна. Применение же тестостерона у мужчин, напротив, может стать причиной возникновения или утяжеления СОАС.
СОАС нередко возникает на фоне различных заболеваний, приводящих к нарушению носового дыхания (аллергический ринит, полипозный риносинуит, искривление носовой перегородки). Направленное на преодоление возникшего препятствия дополнительное дыхательное усилие углубляет отрицательное давления вдоха и способствует возникновению глоточного коллапса. Впрочем единственной причиной возникновения СОАС затрудненное дыхание через нос оказывается достаточно редко.
Часто к фарингеальной обструкции во время сна приводят гипертрофия нёбного язычка, мягкого нёба и миндалин, парез голосовых складок. Интенсивные колебания стенок верхних дыхательных путей ведут к хронической микротравматизации мягкотканных структур глотки и в первую очередь нёбного язычка и мягкого нёба. Развивающийся в результате отек приводит к дальнейшему сужению просвета верхних дыхательных путей, что в свою очередь способствует еще большей их обструкции.
СОАС нередко возникает на фоне различных челюстнолицевых аномалий, наиболее значимыми из которых являются микро‑ и ретрогнатия, то есть маленькие размеры нижней челюсти и ее смещение в заднем направлении. Возникновение обструктивных нарушений дыхания во время сна при этих пороках развития объясняется уменьшением переднезаднего размера глотки.
Гипотиреоз является еще одним фактором, нередко способствующим возникновению СОАС. Считается, что появление обструктивных нарушений дыхания во время сна у больных с пониженной функцией щитовидной железы связано с увеличением размеров языка, микседематозной инфильтрацией стенок глотки, дисгормональной миопатией и нарушениями нейромышечного контроля за состоянием верхних дыхательных путей.
СОАС является частым спутником и осложнением акромегалии. Это в частности объясняется свойственной заболеванию макроглоссией.
Понижая тонус мышц верхних дыхательных путей, алкоголь, снотворные и седативные препараты, наркотические анальгетики и средства для наркоза могут приводить к утяжелению СОАС или к его появлению у предрасположенных лиц.
Курение или регулярный контакт с различными воздушными ирритантами могут способствовать возникновению или прогрессированию СОАС за счет отека слизистой оболочки глотки, приводящему к сужению просвета верхних дыхательных путей. Показано, что у курильщиков СОАС наблюдается достоверно более часто по сравнению с некурящими.
Хотя роль наследственных факторов в возникновении СОАС все еще остается не до конца ясной, в ряде случав это патологическое состояние явно генетически детерминировано и в некоторых семьях передается из поколения в поколение. На сегодняшний день не доказано существование гена, самостоятельно отвечающего за наследование СОАС. Скорее всего передается некая предрасположенность к возникновению дыхательных расстройств (склонность к избытку веса, особенности строения лицевого скелета и т.д.), которая затем может реализоваться или нет в зависимости от различных внешних факторов.
7. КЛИНИЧЕСКАЯ КАРТИНА
Характерным признаком СОАС является храп, который перемежается короткими периодами тишины, соответствующими эпизодам апноэ, и часто бывает настолько громким, что нарушает сон окружающих. Храп может усиливаться после употребления алкоголя перед сном, при применении снотворных и седативных средств, а также на фоне прибавки веса.
Исключение могут составлять некоторые пациенты у которых неадекватная хирургическая коррекция “храпа” привела к устранению звукового феномена при сохранении имевших место дыхательных расстройств. Кроме того, больные с нейромышечными заболеваниями, поражающими мускулатуру грудной клетки и диафрагмы, кифосколиотической деформацией грудной клетки или крайней степенью ожирения в ряде случаев могут оказаться просто не в состоянии генерировать усилие вдоха, достаточное для того, чтобы вызвать звук храпа. В этом случае эквивалентом храпа может явиться шумное прерывистое дыхание.
У части пациентов выраженность храпа, а соответственно и обструкции верхних дыхательных путей зависит от положением тела, возрастая во время сна на спине и уменьшаясь на боку. Это явление связано с тем, что в положении на спине язык и мягкое нёбо смещаются кзади под действием силы тяжести, приводя к сужению просвета глотки. Замечено, что подобная зависимость тяжести СОАС от позы во время сна более характерна для пациентов с относительно меньшим весом, хотя данная закономерность отмечается не во всех случаях.
Возникающие респираторные паузы иногда заметны со стороны, могут пугать окружающих и послужить непосредственной причиной обращения пациента к врачу. Возобновлению дыхания обычно сопутствует взрывной храп, вздохи, стоны или бормотание.
Эпизоды апноэ могут приводить к частым переменам положения тела и к повышенной двигательной активностью рук и ног. Больной с выраженными нарушениями в этот момент может даже упасть с кровати. Все это в сочетании с громким храпом часто заставляет партнера пациента перебираться на ночь не просто в отдельную кровать, но и в другую комнату.
Хотя сопровождающие обструкцию верхних дыхательных путей реакции активации вызывают нарушение структуры сна, полное поведенческое пробуждение в этот момент в большинстве случаев не наступает. В результате многие пациенты зачастую не подозревают о тех аномалиях, которые наблюдаются у них в течение ночи. Однако часть больных все же обращается именно с жалобами на беспокойный сон с частыми пробуждениями. Последнее чаще встречается у пациентов более пожилого возраста.
Пробуждения могут сопровождаться чувством нехватки воздуха вплоть до удушья, которое обычно достаточно быстро проходит самостоятельно, сердцебиением, ощущением дискомфорта в грудной клетке, страхом. Некоторым пациентам кажется, что они просыпаются от кошмарных сновидений. Иногда при пробуждении у больных может отмечаться состояние дезориентации, невозможности сосредоточиться и дискоординации, которое получило название опьяненности сном.
Одна из ошибок, которую часто допускают практические врачи при столкновении со страдающими СОАС пациентами, основывается на формальном подходе к оценке их жалоб на плохое качество сна. Упоминание о тревожном, прерывистом сне часто приводит к назначению снотворных и седативных препаратов, многие из которых в случае СОАС не просто бесполезны, но и потенциально вредны. Следует помнить, что нарушения сна – обширная и гетерогенная группа расстройств, требующая адекватной диагностики и дифференцированной терапии.
Многих пациентов после пробуждения беспокоит выраженная сухость во рту и в горле, что вынуждает их регулярно пить жидкость в течение ночи и по утрам. Причиной этого неприятного ощущения являются храп и дыхание преимущественно через рот во время сна.
Нередко больные отмечают выраженную потливость во время сна. При этом наиболее обильное потоотделение наблюдается в области головы, шеи и грудной клетки. Этот симптом по всей видимости связан со возрастающей работой дыхательной мускулатуры в момент возникновения обструкции верхних дыхательных путей.
Ноктурия является одним из достаточно характерных для СОАС симптомов. Сохраняющиеся во время обструктивного апноэ неэффективные попытки вдоха вызывают снижение внутригрудного давления. Возникающий при этом присасывающий эффект в свою очередь приводит к увеличению венозного возврата к сердцу – так называемой центральной псевдогиперволемии – и растяжению правого предсердия. В результате повышается секреция предсердного натрийуретического фактора, стимулируется выделение натрия и увеличивается образование мочи. Кроме того, сопровождающее обструктивные апноэ повышение внутрибрюшного давления также может способствовать возникновению позыва к мочеиспусканию при пробуждении.
Частое мочеиспускание в течение ночи у мужчин с СОАС в ряде случаев ошибочно трактуется как проявление аденомы предстательной железы. При клинической оценке данного симптомам следует иметь в виду, что для аденомы характерны частые позывы с затрудненным мочеиспусканием и отхождением небольшого количества мочи, тогда как при СОАС мочеиспускание обильное и свободное. Мы неоднократно сталкивались с ситуацией, когда длительно наблюдавшийся до этого у урологов пациент после нормализация дыхания во время сна в значительной степени избавлялся от ночной дизурии.
Повышение давления внутри брюшной полости и желудка во время сопровождающих обструктивные апноэ неэффективных дыхательных попыток может приводить к забросу в пищевод желудочного содержимого. Клиническая картина, обусловленная рефлюксом, при СОАС ничем не отличается от таковой при классической гастроэзофагеальной рефлюксной болезни и может включать большой диапазон симптомов от изжоги, кислой отрыжки и кашля до ларинго‑ и бронхоспазма, возникающих при попадании содержимого желудка в дыхательные пути. Однако специфика патогенетических механизмов в этом случае предрасполагает к упорному течению болезни даже на фоне медикаментозной терапии, которая в других случаях оказалась бы вполне адекватной.
Утром пациенты не чувствуют себя отдохнувшими независимо от того, сколько времени они провели в постели. Часто больные жалуются на тупую генерализованную головную боль, которая обычно проходит самостоятельно через некоторое время после пробуждения, но иногда вынуждает их регулярно принимать анальгетики.
Закономерным последствием нарушения нормальной структуры сна является избыточная дневная сонливость. Понятие сонливости является достаточно индивидуальным, поэтому некоторые пациенты могут субъективно воспринимать свое состояние как постоянное ощущение усталости, разбитости или утомленности в течение дня. В этом случае им иногда ошибочно выставленяется “модный” сегодня диагноз синдрома хронической усталости.
Следует иметь ввиду, что часть больных некритично относится к своему состоянию и может преуменьшать степень имеющейся у них сонливости или, напротив, гордиться своей способностью спать в любом месте и в любое время. Кроме того, не всегда выраженность симптоматики напрямую зависит от величины индекса апноэ‑гипопноэ. Опыт показывает, что в ряде случаев пациенты с умеренными расстройствами дыхания во время сна жалуются на выраженную сонливость, в то время как некоторые больные со значительным числом эпизодов апноэ, напротив, предъявляют минимум жалоб.
Однако сонливость обычно становится очевидной, когда больные находятся в расслабленном состоянии, и проявляется засыпаниями во время отдыха, чтения, просмотра телепрограмм. При крайне выраженной сонливости возможны приступообразные засыпания во время беседы, еды, прогулок или при вождении автомобиля, из‑за чего существенно возрастает риск несчастных случаев. У некоторых больных могут наблюдаются эпизоды автоматического поведения, когда человек неосознанно совершает какие‑то простые, зачастую – бессмысленные, действия с последующей ретроградной амнезией. Типичным примером такого поведения может служить рассказ одного из наших пациентов о том, как он периодически обнаруживал себя едущим в общественном транспорте в совершенно непонятном и ненужном ему направлении.
Следствием хронической нехватки REM‑сна может явиться вкрапление в бодрствование некоторых характерных для него феноменов. Это проявляется гипнагогическими галлюцинациями (галлюцинациями засыпания), представляющими собой напоминающие сновидения образы при еще сохраняющемся контроле над своим “Я”.
Императивные засыпания, гипнагогические галлюцинации и эпизоды автоматического поведения являются характерными симптомами нарколепсии, что в ряде случаев требует проведения дифференциальной диагностики между этим заболеванием и СОАС.
Нарушения сна, дневная сонливость и воздействие гипоксии на головной мозг приводят к тому, что у больных СОАС часто наблюдаются интеллектуальные и эмоционально‑личностные нарушения – ухудшается память, нарушаются внимание и реакция, страдает способность к обучению, нередко отмечаются депрессия, тревога и раздражительность. Также обструктивные нарушения дыхания во время сна могут вызывать снижение полового влечения и нарушения потенции. В результате у больных возникают трудности на работе и в учебе, проблемы в семье, значительно страдает качество жизни. Неверная трактовка имеющейся симптоматики может привести к навешивания на пациента ярлыка ленивого, неспособного или даже психически нездорового человека.
8. СЕРДЕЧНО‑СОСУДИСТЫЕ И РЕСПИРАТОРНЫЕ ПРОЯВЛЕНИЯ СОАС
СОАС первоначально привлек внимание врачей именно своими сердечно‑легочным осложнениями. В симтомокомплексе, получившем название “синдром Пиквика”, доминировали признаки дыхательной недостаточности и хронического легочного сердца. Однако вскоре стало ясно, что СОАС не всегда представлен клинической картиной, описанной C. S. Burwell, может в течение многих лет проявляться лишь шумным храпом и только под влиянием не до конца понятных пока факторов у небольшой части пациентов приводит к появлению клинической формы, которую и наблюдали авторы “Пиквикского синдрома”. Тем не менее показано, что наличие обструктивных нарушений дыхания во время сна является независимой причиной возникновения различных кардиореспираторных расстройств, многие из которых становятся причиной ранней инвалидизации и преждевременной смерти. Адекватное лечение СОАС, напротив, ведет к существенному снижению сердечно‑сосудистой заболеваемости и смертности в этой группе больных.
В соответствии с существующими на сегодняшний день взглядами, наблюдающиеся у пациентов с СОАС кардиореспираторные аномалии в первую очередь обусловлены расстройствами газообмена, нарушениями в структуре сна и колебаниями внутригрудного давления в результате возрастающих в момент обструкции дыхательных усилий.
Сопровождающая обструкцию верхних дыхательных путей гипоксемия является типичным признаком СОАС, синхронизирована с эпизодами апноэ или гипопноэ и вследствие этого носит циклический характер (рис.7).
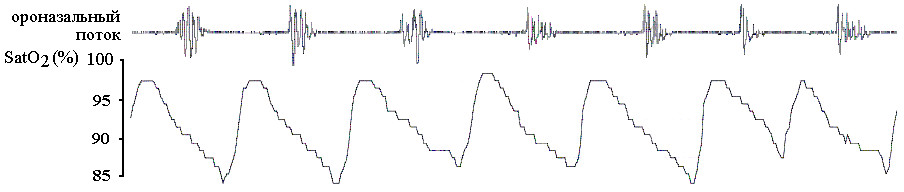
Рис. 7. Ассоциированные с апноэ эпизоды десатурации.
Сатурация кислорода начинает снижаться вскоре после возникновения обструкции верхних дыхательных путей и в большинстве случаев возвращается к исходному уровню вслед за восстановлением нормального дыхания. Выраженность возникающей гипоксемии зависит от длительности респираторных эпизодов, ёмкости легких, исходного насыщения крови кислородом, скорости его потребления и от объема сохраняющейся вентиляции. Поэтому в случае, когда легкие исходно способны обеспечить достаточный запас и концентрацию кислорода, короткие эпизоды апноэ и гипопноэ могут не приводить к десатурации оксигемоглобина. Напротив, у пациентов с сопутствующими хроническими обструктивными заболеваниями легких или альвеолярной гиповентиляцией на фоне ожирения коротких периодов между дыхательными паузами может оказаться недостаточно для того, чтобы восстанавливать насыщение кислородом не только артериальной, но и венозной крови. В результате, хотя сатурация кислорода продолжает возвращаться к исходному уровню после возобновления дыхания, у пациента наблюдается прогрессирующее нарастание глубины и скорости десатураций от одного эпизода апноэ к другому, так как в легкие возвращается все менее оксигенированная кровь. Если же компенсаторные механизмы оказываются нарушенными в еще большей степени, у больного может возникать выраженная гипоксемия в течение всего времени сна (рис.8).
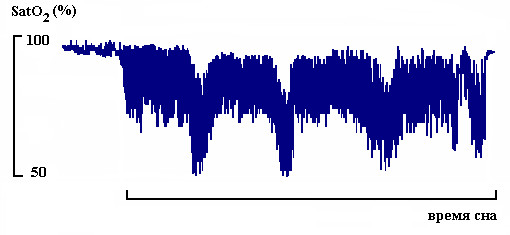
Рис. 8. Гипоксемия во время сна у пациента с морбидным ожирением и тяжелым СОАС
Кроме того нарушения легочной вентиляции приводят к повторным эпизодам гиперкапнии, которая обычно сменяется нормо‑ или даже гипокапнией в результате возникающей после восстановления нормального дыхания компенсаторной гипервентиляции.
Хроническая альеолярная гиповентиляция обычно не упоминается в числе характерных осложнений СОАС. Тем не менее гиперкапническая форма дыхательной недостаточности в состоянии бодрствования по данным разных авторов выявляется у 12‑23% пациентов с обструктивными нарушениями дыхания во время сна, а сочетание морбидного ожирения и СОАС приводит к гиповентиляции в состоянии бодрствования уже у половины больных.
Альвеолярная гиповентиляция развивается в результате взаимодействия между изменениями центральных механизмов регуляции и периферическими нарушениями механики дыхания, в основе которых лежат ожирение, бронхиальная обструкция и тяжесть дыхательных расстройств во время сна. При этом не смотря на то, что обструктивные нарушения дыхания во время сна по всей видимости являются независимой причиной возникновения хронической дыхательной недостаточности у этих больных, при отсутствии выраженного ожирения или бронхиальной обструкции газы крови в состоянии бодрствования обычно остаются в пределах нормы даже при наличии достаточно тяжелого СОАС. Кроме того похоже, что все перечисленные факторы лишь в той или иной степени предрасполагают к возникновению хронической альвеолярной гиповентиляции, а не предопределяют ее появление. В пользу этого говорит то, что у некоторых больных может иметь место выраженный СОАС в сочетании с хронической бронхолегочной патологией или значительным ожирением, но отсутствовать гиперкапния в состоянии бодрствования.
По всей видимости природа хронической дыхательной недостаточности у пациентов с СОАС является многофакторной и может отличаться у разных больных, что позволяет говорить о апноэ‑независимом и апноэ‑зависимом вариантах хронической альвеолярной гиповентиляции. Об этом свидетельствует тот факт, что хотя коррекция обструктивных нарушений дыхания во время сна во многих случаях приводит к повышению чувствительности к СО2, улучшению альвеолярной вентиляции, снижению или даже нормализации рСО2 и, соответственно, уменьшению гипоксемии в состоянии бодрствования, у части пациентов положительная динамика показателей газообмена не наблюдается. В последнем случае речь идет о истинном, не связанном с СОАС, синдроме альвеолярной гиповентиляции при ожирении или последствиях выраженной обструкции бронхов.
Отражением формирующейся дыхательной недостаточности становится вторичный эритроцитоз, который может развиться у пациентов с СОАС даже при отсутствии хронических заболеваний легких и приводит к нарушению реологических свойств крови, повышая риск возникновения различных сосудистых катастроф.
У больных с СОАС, как правило, наблюдаются циклические изменения давления в легочной артерии во время сна. Оно умеренно снижается в начале эпизода апноэ, несколько возрастает к его концу и достигает наибольшей величины после возобновлении легочной вентиляции, а затем снижается. Повышение легочного артериального давления пропорционально степени возникающей гипоксемии.
Эти изменения легочной гемодинамики по всей видимости представляют собой результат взаимодействия нескольких факторов, включая гипоксическую вазоконстрикцию и изменения внутригрудного давления, возникающие в результате неэффективных дыхательных попыток.
Повторяющиеся апноэ могут приводить к серьезной легочной гипертензии в течение ночи. Повышенное давление в легочной артерии в состоянии бодрствования, чаще – умеренное, встречается в среднем у 20% больных с СОАС, но в отдельных выборках легочная гипертензия наблюдается существенно чаще.
Хотя до недавнего времени преобладало мнение, что повышение давления в легочной артерии в состоянии бодрствования у больных с СОАС является следствием хронических нарушений газообмена в результате бронхиальной обструкции и ожирения, в ряде исследований показано, что легочная гипертензия может быть связана непосредственно с обструктивными нарушениями дыхания во время сна, а наличие дневной гипоксемии не всегда является обязательным условием ее возникновения.
Сочетание обструктивного апноэ с хроническими обструктивными заболеваниями легких получило название “синдрома перекреста” (Flenley D. S., 1985), являющегося по своей сути синдромом взаимного отягощения. Подобное сочетание наблюдается у 11‑13% больных с СОАС. Комбинация двух различных этиологических факторов приводит к более тяжелой дыхательной недостаточности. В результате хроническая легочная гипертензия и правожелудочковая сердечная недостаточность возникают у них существенно чаще и в более ранние сроки, чем если бы они имели только одно из этих патологических состояний, несмотря на то, что многие из них исходно имеют сравнительно мало измененные показатели вентиляционной функции легких.
Клинически значимая правожелудочковая недостаточность развивается у 12‑27% пациентов с СОАС. Кажется маловероятным, что изолированные эпизоды ночной гипоксемии способны самостоятельно привести к правосердечной декомпенсации при отсутствии дыхательной недостаточности в дневное время. Тем не менее, хотя наличие хронических нарушений газообмена очевидно является обязательным условием ее возникновения, мы склоняемся к мнению, что обструктивные апноэ вносят свой самостоятельный вклад в возникновение правосердечной недостаточности, усугубляя последствия бронхиальной обструкции и ожирения.
Коррекция СОАС предотвращает ночные повышения давления в легочной артерии. Нормализация дыхания во время сна у части пациентов вызывает снижение легочного артериального давления и в состоянии бодрствования. При наличии хронического легочного сердца устранение СОАС приводит к улучшению функционального состояния правого желудочка, что у части пациентов с клиникой правосердечной недостаточности позволяет добиться уменьшения или даже исчезновения периферических отеков без дополнительной медикаментозной терапии.
Эпизоды обструктивного апноэ вызывают колебания системного артериального давления, по своему паттерну похожие на изменения давления в легочной артерии. Оно постепенно возрастает к концу апноэ и достигает своего максимума при возобновлении дыхания, после чего постепенно снижается. При этом величина артериального давления коррелирует с тяжестью вызываемой апноэ десатурации. Возникающие нарушения структуры сна также вносят свой вклад в постапнойное повышение артериального давления. Полагают, что сочетанное воздействие гипоксии, гиперкапнии и активации обуславливает повышение симпатического тонуса и спазм периферических сосудов, с чем и связана наблюдающаяся на фоне обструктивного апноэ гипертензивная реакция. Показано, что у больных с сонным апноэ ночные колебания артериального давления даже при отсутствии дневной гипертонии могут вызывать гипертрофию стенок левого желудочка.
Характерным признаком СОАС является отсутствие физиологического снижения артериального давления во время сна или даже его повышение в течение ночи, причем выраженность изменений суточного профиля артериального давления в значительной степени зависит от тяжести имеющихся у больного дыхательных расстройств (рис.9). В результате величина артериального давления утром может оказаться выше, чем в вечерние часы даже при отсутствии гипотензивной терапии.
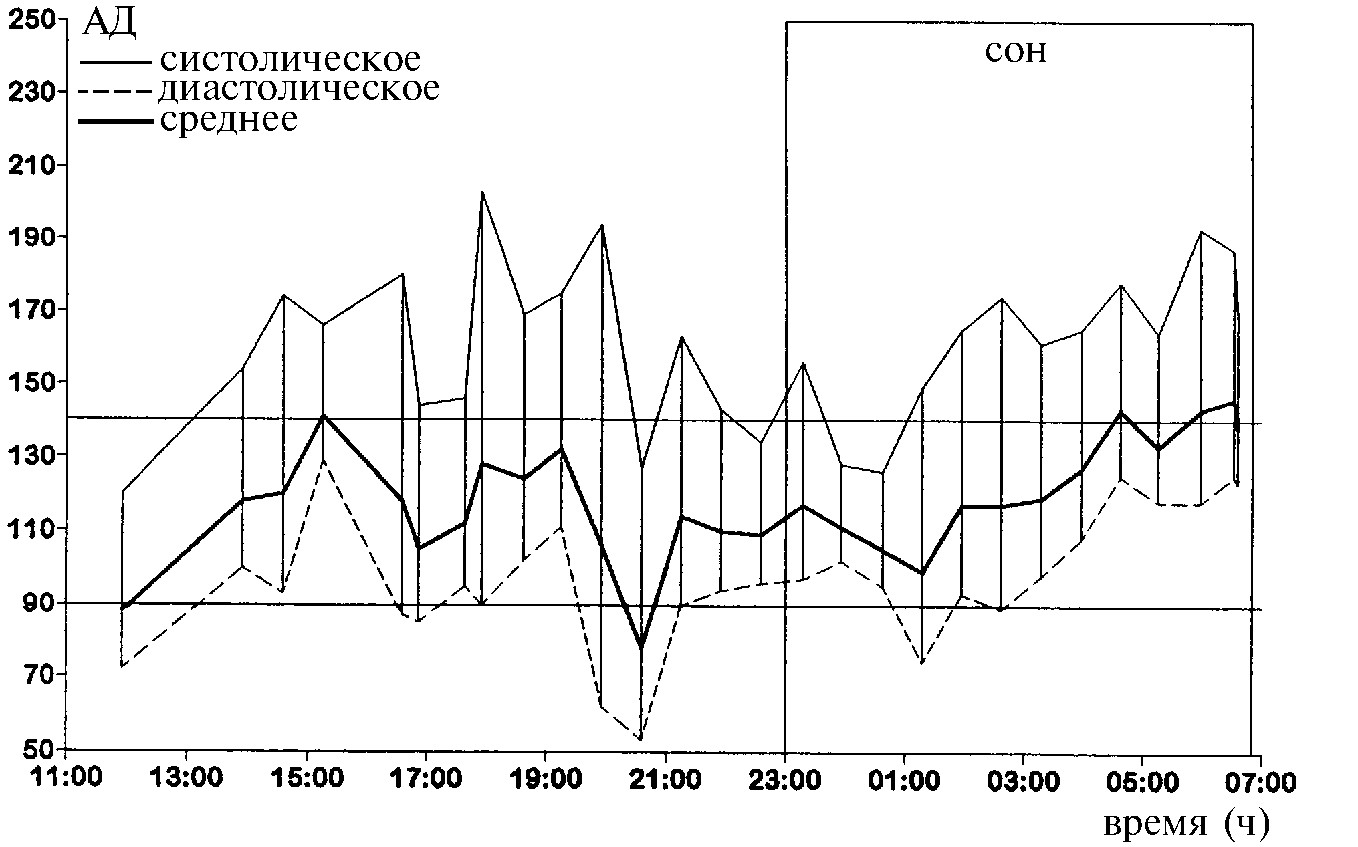
Рис. 9. Постепенное повышение артериального давления во время сна у пациента с тяжелым СОАС
Артериальная гипертония в состоянии бодрствования встречается более чем у половины больных с СОАС и наблюдается в этой группе в два раза чаще, чем в популяции в целом. И хотя повышение артериального давления не обязательно является у них всех прямым следствием дыхательных нарушений во время сна, а может быть связано с другими причинами, такими как пол, ожирение или возраст, показано, что наличие СОАС представляет совершенно самостоятельный фактор риска возникновения артериальной гипертонии.
До настоящего времени не вполне ясно каким образом нарушения дыхания во время сна могут привести к повышению артериального давления в дневные часы. Возможно, что обусловленная эпизодами апноэ активация симпатического отдела вегетативной нервной системы распространяется и на время бодрствования, что косвенно подтверждает выявляемое у пациентов с СОАС повышенное содержание катехоламинов в крови и моче и уменьшение их концентрации через некоторое время после нормализации дыхания во время сна.
Классическая “утренняя” гипертония, иногда описываемая в литературе как типичная, на практике встречается сравнительно редко. Более частой находкой становится систоло‑диастолическая или преимущественно диастолическая артериальная гипертония с достаточно высокими цифрами артериального давления и в утренние, и в вечерние часы. При этом величина как систолического, так и диастолического артериального давления в состоянии бодрствования нередко зависит от тяжести дыхательных расстройств во время сна.
Артериальная гипертония у больных с СОАС в ряде случаев может оказаться рефрактерной к медикаментозной терапии. Опыт показывает, что даже в том случае, когда удается контролировать величину артериального давления в течение дня, у части пациентов к утру оно вновь оказывается существенно повышенным.
Факт значительного повышения диастолического давления часто наталкивает врачей на мысль о нефрогенной природе этой артериальной гипертонии. Когда же никакой значимой патологии почек найти не удается, у пациентов с выраженным ожирением иногда еще исключается синдром Иценко‑Кушинга, после чего они автоматически зачисляются в группу больных гипертонической болезнью. Следствием этой порочной практики является показанный эпидемиологическими исследованиями факт, что около трети больных, якобы страдающих эссенциальной гипертонией, имеют СОАС той или иной степени тяжести.
Коррекция сонного апноэ не только предотвращает ночные подъемы артериального давления, но у части пациентов приводит к его самостоятельному снижению и в дневные часы без дополнительного назначения гипотензивных средств, что подтверждает патогенетическую роль СОАС в генезе артериальной гипертонии. Даже в том случае, если артериальное давление в состоянии бодрствования не претерпевает существенных изменений, у больных с исходно рефрактерной к медикаментозной терапии артериальной гипертонией нормализация дыхания во время сна нередко позволяет восстановить чувствительность к гипотензивным лекарственным средствам. Этот эффект необходимо учитывать при начале терапии СОАС у больных, получающих на ночь понижающие артериальное давление препараты, так как подобное сочетание может привести у них к выраженной ночной гипотензии.
Однако во многих случаях повышение артериального давления может быть и не связано с дыхательными расстройствами во время сна. В этой связи представляется целесообразным разделить больных с СОАС и артериальной гипертонией на три группы. Первая включает пациентов с артериальной гипертонией, являющейся прямым следствием обструктивных нарушений дыхания во время сна. Это больные с ночной и утренней артериальной гипертонией, которая рефрактерна к лекарственной гипотензивной терапии, но быстро исчезает после устранения СОАС. Именно у таких пациентов величина артериального давления в состоянии бодрствования непосредственно определяется тяжестью расстройств дыхания во время сна. Обычно это бывают сравнительно молодые больные с достаточно тяжелым СОАС.
Ко второй группе можно отнести пациентов, у которых СОАС является только одной из причин формирования артериальной гипертонии.
Последняя группа состоит из пациентов, у которых артериальная гипертония патогенетически никак не связана с СОАС, и возникает в результате каких‑либо других причин. Коррекция СОАС у них не приводит к снижению артериального давления.
Если у пациентов первой группы лечение артериальной гипертонии имеет смысл начинать с нормализации дыхания во время сна, то представители второй и третьей группы нуждаются в подборе медикаментозной терапии. К сожалению окончательно отдифференцировать к какой из групп относится тот или иной пациент во многих случаях удается только на основании результатов лечения.
Полагают, что у пациентов с СОАС ночные нарушения дыхания могут явиться самостоятельной причиной левосердечной недостаточности, хотя механизм возникновения последней остается не до конца ясен. В пользу наличия такой взаимосвязи говорит в частности тот факт, что у пациентов с сочетанием СОАС и левожелудочковой сердечной недостаточности устранение обструктивных нарушений дыхания во время сна часто сопровождается улучшением показателей гемодинамики. В этой связи обсуждается возможная роль артериальной гипертонии, гипоксически‑опосредованного повреждения миокарда и гемодинамических эффектов, обусловленных изменениями внутригрудного давления.
В отдельных случаях тяжелый СОАС может стать причиной отека легких во время сна. Причем это могут быть пациенты с исходно нормальными показателями систолической и диастолической функции левого желудочка. Остается не вполне ясным за счет каких механизмов обструктивные нарушения дыхания во время сна могут вызывать отек легких. Высказываются предположения, что это может быть результатом выраженной гипоксемии и возрастающего венозного возврата на фоне апноэ. Коррекция СОАС у таких пациентов предотвращает повторное возникновение этого грозного осложнения.
Для больных с СОАС характерны нарушения ритма сердца и проводимости во время сна. У большинства пациентов эпизоды апноэ сопровождает синусовая аритмия, характеризующаяся прогрессирующей брадикардией, в некоторых случаях вплоть до периода асистолии, которая резко сменяется тахикардией после возобновления легочной вентиляции (рис.10).
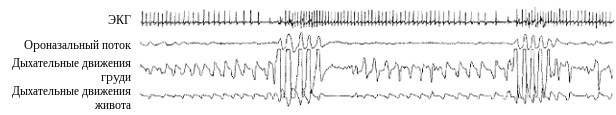
Рис. 10. Сопровождающая эпизоды обструктивного апноэ синусовая аритмия
Эти нарушения ведут к увеличению вариабельности частоты сердечных сокращений во время сна, а кривая частоты сердечных сокращений в результате приобретает своеобразную синусоидоподобную форму (рис.11).
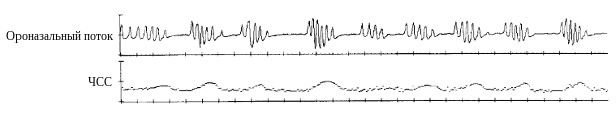
Рис. 11. Изменения частоты сердечных сокращений на фоне эпизодов апноэ
Степень урежения частоты сердечных сокращений коррелирует с длительностью эпизода апноэ и тяжестью возникающей гипоксемии. При этом в состоянии бодрствования вдыхание гипоксической смеси приводит у тех же больных к возрастанию частоты сердечных сокращений. Это согласуется с описанным в литературе “рефлексом ныряльщика”, в соответствии с которым гипоксия вызывает брадикардию или тахикардию в зависимости от отсутствия или наличия легочной вентиляции. Кроме того, сопровождающее возобновление дыхания повышение симпатического тонуса вносит дополнительный вклад в генез возникающей после окончания апноэ тахикардии.
Эта аритмия, как правило, не сопровождается субъективной симптоматикой, не является отражением какого‑либо заболевания сердца, никогда не возникает в состоянии бодрствования и полностью исчезает после устранения СОАС. Связанную с обструктивными нарушениями дыхания синусовую аритмию во время сна иногда неверно трактуют как проявление синдрома слабости синусового узла. Известны случаи, когда неправильная интерпретация причины подобных нарушений приводила к необоснованной имплантации искусственного водителя ритма таким пациентам (рис.12).
Рис. 12. Искусственный водитель ритма у пациента с эпизодами выраженной брадикардии и синусовыми паузами на фоне СОАС
Вопрос о клинической значимости связанной с СОАС синусовой аритмии до настоящего времени дискутируется. Выраженная брадикардия вызывает существенное падением перфузии, что в сочетании с вызываемой апноэ десатурацией может повышать риск гипоксического повреждения органов. Хотя не установлено достоверно является ли вызываемая апноэ асистолия фактором риска смерти во время сна, у некоторых больных, в первую очередь при наличии сопутствующих сердечно‑сосудистых заболеваний, нельзя исключить такой механизм.
Кроме того, у пациентов с СОАС во время сна могут наблюдаться частая предсердная и желудочковая экстрасистолия, преходящая атриовентрикулярная блокада разных степеней, суправентрикулярная или желудочковая тахикардия. Обычно эти явления возникают на фоне значительного снижения сатурации кислорода, чаще у пациентов с сопутствующей сердечно‑сосудистой патологией. При отсутствии последней даже тяжелую форму СОАС может сопровождать только синусовая брадитахиаритмия.
Возможно, что именно нарушения сердечного ритма могут являться у больных с СОАС одной из причин внезапной смерти, хотя последнее предположение относится к разряду насколько вероятных, настолько и трудно доказуемых гипотез.
Коррекция СОАС нередко оказывает одновременный противоаритмический эффект, позволяя во многих случаях уменьшить или даже устранить ночные нарушения ритма и проводимости без дополнительной медикаментозной терапии.
Около трети пациентов, страдающих ишемической болезнью сердца, имеют СОАС. Не смотря на то, что обструктивные нарушения дыхания во время сна встречается у пациентов с ишемической болезнью сердца существенно чаще, чем в популяции, взаимосвязь между этими заболеваниями не считается общепризнанной. Тем не менее в ряде исследований показано, что СОАС является независимым фактором риска возникновения ишемической болезни сердца, включая инфаркт миокарда. Повышение артериального давления, оксидативный стресс и связанная с ним активация перикисного окисления липидов, симпатическая активация и эндотелиальная дисфункция – вот лишь неполный список механизмов, через которые может реализовываться эта взаимосвязь. Клинические наблюдения показывают, что коррекция СОАС заметно замедляет прогрессирование заболевания и достоверно снижает риск смерти от ишемической болезни сердца.
Ночные эпизоды стенокардии и немой ишемии миокарда, связанные с обструктивными апноэ, у пациентов с ишемической болезнью сердца обычно возникают на фоне выраженной гипоксемии и в этом случае могут не профилактизироваться приемом нитратов. Коррекция СОАС в таком случае может оказаться единственным методом лечения, позволяющим эффективном предотвращать ишемию миокарда во время сна.
Повторные обструктивные апноэ вызывают значительные колебаниям мозгового кровотока, что в определенные моменты может привести к критическому снижению церебральной перфузии. Если учесть, что подобные явления возникают на фоне имеющихся у пациентов с СОАС хронических нарушений церебрального кровообращения, совпадают с повышением артериального давления и вызванной апноэ гипоксемией, становится понятным каким образом обструктивное апноэ может не только существенно повышать риск, но и становиться непосредственной причиной острого нарушения мозгового кровообращения.
Таким образом, для больных с СОАС характерно наличие большого числа различных сердечно‑сосудистых и респираторных нарушений. Причем обструктивные нарушения дыхания во время сна являются не только самостоятельной, но и весьма значимой причиной множества кардиореспираторных расстройств. Осознание этого факта имеет не столько научное, сколько большое практическое значение. Необходимо понимать, что симптоматическое лечение имеющихся у таких пациентов нарушений дыхания и гемодинамики часто оказывается недостаточно эффективным и не может подменять собой патогенетическую терапию, направленную на непосредственную коррекцию СОАС.
9. СОАС И МЕТАБОЛИЧЕСКИЙ СИНДРОМ
Метаболический синдром представляет собой симптомокомплекс, включающий абдоминальную форму ожирения, дислипидемию, повышение артериального давления, инсулинорезистентность и нарушение толерантности к глюкозе, а также высокую активность сосудистого воспаления и предрасположенность к тромбозам. Основным компонентом метаболического синдрома считается инсулинорезистентность, приводящая к компенсаторной гиперинсулинемии и в значительной мере определяющая развитие остальных метаболических и гемодинамических нарушений. Не менее важным фактором является ожирение, которое, с одной стороны, является результатом низкой чувствительности к инсулину, а с другой – само приводит к усугублению метаболических нарушений и прогрессированию инсулиновой резистентности. Сочетание стольких факторов риска приводит к раннему развитию и прогрессированию атеросклероза и в конечном счете к возникновению большого числа сердечно‑сосудистых осложнений.
Обращает на себя внимание значительное клиническое сходство между пациентами с СОАС и с метаболическим синдромом – обструктивные расстройства дыхания во время сна часто возникают на фоне ожирения, нередко сочетаются с разнообразными обменными нарушениями и могут самостоятельно приводить к повышению артериального давления. Это позволяет предположить, что такие патологические состояния могут не только сосуществовать, но и взаимно отягощать друг друга. Однако единство мнений по этому вопросу отсутствует. В то время как одни авторы не усматривают достоверной зависимости между метаболическими аномалиями и СОАС, а частое сочетание этих патологических состояний объясняют схожими предрасполагающими факторами, другие, напротив, предлагают рассматривать расстройства дыхания во время сна в качестве еще одной составляющей метаболического синдрома.
Взаимосвязь между обструктивными нарушениями дыхания во время сна и метаболическим синдромом сложна и неоднозначна.
С одной стороны, будучи одним из основных компонентов метаболического синдрома, ожирение также является ведущим фактором риска СОАС.
С другой стороны, накапливается все больше данных в пользу того, что СОАС может являться самостоятельной причиной происхождения метаболических нарушений. В ряде исследований была продемонстрирована независимая роль обструктивных нарушений дыхания во время сна в качестве фактора, ведущего к возникновению инсулинорезистентности, дислипидемии и сахарного диабета 2 типа. Подтверждает причинно‑следственную связь между СОАС и метаболическими нарушениями также тот факт что, устранение расстройств дыхания во время сна сопровождается повышением чувствительности к инсулину, приводит к улучшению показателей обмена глюкозы и может способствовать снижению веса.
До настоящего времени механизмы, ответственные за нарушение толерантности к глюкозе у пациентов с СОАС не вполне ясны. Предполагается, что гипоксия и фрагментация сна приводят к инсулинорезистентности за счет гормональных нарушений, возникающих вследствие изменений функционального состояния гипоталамо‑гипофизарно‑надпочечниковой системы, а также в результате высвобождения ряда адипоцит‑опосредованных гормонов и цитокинов.
Таким образом, возникает порочный круг, когда осложнения сахарного диабета 2 типа способствуют возникновению СОАС, а обструктивные нарушения дыхания во время в свою очередь вызывают инсулинорезистентность и нарушение толерантности к глюкозе. Иными словами, существует достаточно большое число больных обменные нарушения у которых можно в значительной степени рассматривать в качестве осложнений СОАС. Коррекция сонного апноэ для таких пациентов является непременным компонентом адекватной терапии метаболического синдрома.
10. ДИАГНОСТИКА СОАС
Частая встречаемость обструктивных нарушений дыхания во время сна среди пациентов терапевтического профиля при отсутствии на сегодняшний день реальной возможности провести специальное углубленное обследование всем потенциально нуждающихся в этом больным обуславливает необходимость выработки оптимальных подходов к диагностике СОАС в клинике внутренних болезней. Приводимый алгоритм поэтапного диагностического поиска иллюстрирует, каким образом на наш взгляд это можно сделать наиболее рационально, исходя из возможностей, которыми в настоящее время располагают отечественные стационары терапевтического профиля (алгоритм 1).
Сочетание храпа, остановок дыхания во время сна и избыточной дневной сонливости в той или иной комбинации наблюдается практически у всех больных с СОАС, составляет клиническое ядро данного синдрома и обычно является отправной точкой диагностического поиска. Однако получить достоверную информацию о наличии этих симптомов не всегда бывает столь просто, как это может показаться с первого взгляда.
Говоря о наличии или отсутствии храпа пациент вынужден обсуждать с врачом событие, происходящее с ним во время сна. Опыт показывает, что если одновременно опрашивать родственников или соседей больного по палате, то в итоге количество храпящих увеличивается в полтора раза. Хотя понятно, что вероятность последующего обнаружения клинически значимых обструктивных нарушений дыхания во время сна у пациентов с регулярным громким храпом будет существенно выше, имеет смысл принимать во внимание наличие храпа любой периодичности и интенсивности. Более того, как уже обсуждалось ранее, даже отсутствие храпа не всегда позволяет полностью исключить у пациента СОАС, хотя и делает этот диагноз существенно менее вероятным.
Остановки дыхания во сне сравнительно редко оказываются среди тех жалоб, которые пациент с СОАС активно предъявляет врачу. Однако при целенаправленном расспросе выясняется, что периоды апноэ во время сна окружающие замечают более чем у половины из них. Впрочем этот признак может быть не свидетельством о патологии, а лишь отражать дыхательную аритмию, которая в норме наблюдается во время быстрого сна. Поэтому наибольшую диагностическую ценность имеет упоминание о регулярно возникающих дыхательных паузах.
Вопрос о избыточной дневной сонливости следует формулировать максимально развернуто. Дело в том, что длительно болеющие пациенты частично адаптируются и постепенно привыкают к своему состоянию. В результате многие искренне считают, что у них нет никакой сонливости и дадут отрицательный ответ на прямой вопрос о ее наличии. Поэтому проще всего предложить больному оценить вероятность засыпания применительно к различным жизненным ситуациям. Именно по такому принципу построена предложенная M. W. Johns (1991) Эпвортская шкала дневной сонливости (таблица 3). Благодаря своей простоте и сравнительно высокой достоверности получаемых результатов этот опросник получил широкое распространение в качестве одного из основных способов неинструментального выявления избыточной сонливости.
Таблица 3. Эпвортский опросник для оценки степени дневной сонливости3
Пациенту предлагается оценить возможность задремать или даже уснуть в различных ситуациях и оценить вероятность этого в баллах (0 ‑ никогда; 1 ‑ небольшая вероятность; 2 ‑ умеренная вероятность; 3 ‑ высокая вероятность):
- Чтение сидя
- Просмотр телепередач
- Пассивное участие в общественных мероприятиях (сидя в театре, на собрании и т.д.)
- Как пассажир в машине (если поездка длится не менее часа)
- Если прилечь отдохнуть после обеда в отсутствии других дел
- Сидя или разговаривая с кем‑либо
- Сидя спокойно после еды (без употребления спиртного)
- За рулем автомобиля, остановившегося на несколько минут в дорожной пробке или во время короткого перерыва на работе
Уже при уровне сонливости более 5 баллов индекс дыхательных расстройств часто оказывается выше нормы. Сонливость более 10 баллов расценивается как значительная и на практике обычно соответствует выраженному СОАС. Однако даже при таком подходе некоторые пациенты могут неадекватно оценивать свою сонливости. Кроме того, хотя полученная при расчете с помощью Эпвортской шкалы величина в целом коррелирует с индексом дыхательных расстройств, степень сонливости может значительно варьировать у разных больных, не смотря на одинаковую выраженность дыхательных нарушений во время сна, и не позволяет установить истинную тяжесть СОАС. И конечно же следует помнить, что избыточная дневная сонливость не является жалобой, характерной только для обструктивных нарушений дыхания во время сна, поэтому диагностировать СОАС на основании одного этого критерия не представляется возможным.
Существуют и другие опросники, специально адаптированные для первичного выявления пациентов с СОАС. Диагностическое анкетирование удобно тем, что позволяет в короткий срок установить имеющиеся у пациента характерные для СОАС симптомы вне зависимости от его субъективных представлений о своем заболевании и степени специальной подготовки медицинского персонала. Анкетирование помогает установить лиц с повышенным риском наличия СОАС для дальнейшего, более детального их обследования.
Так В.А. Ерошина с соавторами (1999) предложили скрининговое правило в соответствии с которым при наличии трех или более специфических признаков (или только первого признака) необходимо углубленное исследование на предмет выявления СОАС:
- Указания на остановки дыхания во сне
- Указания на громкий или прерывистый храп
- Повышенная дневная сонливость
- Учащенное ночное мочеиспускание
- Длительное (> 6 месяцев) нарушение ночного сна
- Артериальная гипертония (особенно ночная и утренняя)
- Выраженное ожирение
Еще одна анкета, предложеная Т. С. Елигулашвили (1998), представляет собой попытку разработать опросник, который дал бы возможность на основании суммы баллов оценить риск наличия СОАС. Анкета содержит вопросы о симптомах, комбинация которых по данным автора в том или ином варианте наиболее часто встречается у пациентов с обструктивными нарушениями дыхания во время сна. При этом каждому свойственному СОАС феномену был присвоен определенный балл от 1 до 3 в зависимости от степени его специфичности для этого расстройства. Дальнейший анализ показал, что если пациент набирает 4 и более баллов по предложенной анкете, то он страдает СОАС с вероятностью в 96%.
Таблица 4. Анкета для первичной диагностики СОАС
| № | Вопросы | Оценка в баллах |
| 1 | Вы храпите во сне | 1 |
| 2 | Окружающие замечают у Вас остановки дыхания во сне | 3 |
| 3 | Вас беспокоит дневная сонливость: | |
| а) только в расслабленном состоянии или после еды | 1 | |
| б) во время активной деятельности | 3 | |
| 4 | а) У Вас повышеное артериальное давление | 1 |
| б) В большей степени повышается диастолическое артериальное давление | 2 | |
| в) Утром диастолическое артериальное давление выше, чем вечером | 2 | |
| 5 | Вас беспокоят утренние головные боли | 1 |
Наряду с анализом имеющихся жалоб необходимо оценить вероятность возникновения у больного СОАС исходя из имеющихся факторов риска, таких как мужской пол, средний и старший возраст, избыточный вес и большая окружность шеи, патология ЛОР‑органов и челюстно‑лицевые аномалии, данные о наличии СОАС у близких родственников.
К сожалению не существует симптоматики, абсолютно специфичной для СОАС. Кроме того, практически не встречаются пациенты у которых одновременно присутствовали бы все характерные для СОАС признаки, а наблюдающиеся комбинации симптомов разнообразны и непредсказуемы. Хотя в типичных случаях диагноз может быть с высокой степенью вероятности предположен уже на основании клинической картины заболевания, достоверно отличить пациентов с СОАС исходя только из анализа симптомов или с помощью какого‑либо даже самого подробного опросника часто не представляется возможным. Хотелось бы подчеркнуть, что даже если соответствующие клинические признаки на первый взгляд отсутствуют, это не позволяет окончательно исключить наличие достаточно выраженных дыхательных расстройств во время сна. Необходимо автоматически включать СОАС в круг дифференциально‑диагностического поиска у пациентов с любыми патологическими проявлениями, если те возникают или обостряются во время сна. Наличие в анамнезе у больного артериальной гипертонии, инсульта, инфаркта миокарда или эритроцитоза неясной этиологии, на наш взгляд также является достаточным основанием для того, чтобы, как минимум, вспомнить о СОАС.
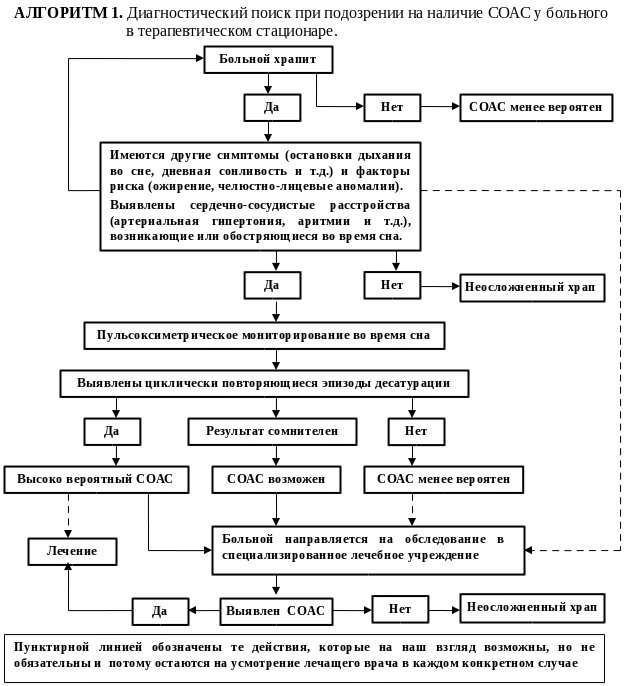
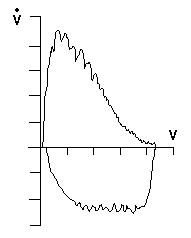 Рис. 13. Кривая “поток‑объем” у пациента с СОАС – симптом | В этой связи закономерным представляется как можно более полное использование возможностей рутинных для клиники внутренних болезней инструментальных методов обследования при проведении первичного скрининга этого патологического состояния. Выявляемые у пациентов с СОАС нарушения вентиляционной функции легких большей частью достаточно неспецифичны и не имеют отношения к имеющимся у них нарушениям дыхания во время сна. Характер изменений функции внешнего дыхания у них в первую очередь определяется степенью ожирения и сопутствующей бронхолегочной патологией. |
Существует ряд признаков, которые отражают имеющиеся у больных с СОАС аномалии верхних дыхательных путей и могут косвенно свидетельствовать в пользу возможного наличия обструктивных нарушений дыхания во время сна. Это увеличение отношения максимального экспираторного потока к максимальному инспираторному потоку на уровне 50% форсированной жизненной емкости легких (MEF50%/MIF50%) больше 1, являющееся косвенным признаком сужения верхних дыхательных путей, и наличие низкоамплитудной зазубренности на кривой форсированного вдоха и/или выдоха, получившее в англоязычной литературе название симптома “зубцов пилы” (рис.13), появление которой отражает колебания тканей верхних дыхательных путей и свидетельствует о их нестабильности при дыхании.
Однако на практике эти изменения наблюдаются лишь у части больных и не являются характерными только для СОАС. В частности они нередко встречаются у пациентов с неосложненным храпом, что существенно снижает их дифференциально‑диагностическую ценность.
Результаты исследования функции внешнего дыхания не позволяют предсказывать присутствие обструктивных нарушений дыхания во время сна. Тем не менее если у больного обнаружен хотя бы один из перечисленных признаков логичным будет задать ему вопрос о наличии храпа и дневной сонливости.
На мысль о возможной связи артериальной гипертонии с обструктивными нарушениями дыхания во время сна должны наводить высокие цифры артериального давления, регистрируемые утром сразу после пробуждения, а так же рефрактерность артериальной гипертонии к адекватной на первый взгляд медикаментозной терапии. Но особенно полезным может оказаться выявленное в результате суточного мониторирования артериального давления отсутствие его физиологического снижения или повышение во время сна (см. рис. 8). Так как СОАС является одной из частых причин, приводящих к подобным изменениям суточного профиля артериального давления, таким больным показано дальнейшее более углубленное обследование, особенно если имеется соответствующая симптоматики или дополнительные факторы риска.
К сожалению, наиболее широко применяющийся на практике способ неинвазивного прерывистого мониторирования артериального давления с помощью раздувающейся манжеты не всегда позволяет адекватно оценить его изменения во время сна у пациентов с СОАС. С одной стороны, при периодической регистрации данных в интервале между измерениями могут произойти значительные колебания артериального давления, связанные с обструктивными эпизодами. С другой стороны, процесс нагнетания воздуха в манжету сам по себе может оказаться достаточным стимулом, чтобы спровоцировать реакцию активации и, соответственно, транзиторное повышение артериального давления. Теоретически это не должно сказываться на конечном результате, так как в этом случае артериальное давление обычно успевает вернуться на исходный уровень к началу измерения. Однако опыт показывает, что у части больных исследование в ночные часы может привести к существенному ухудшению качества сна и исказить суточный профиль артериального давления. Тем не менее, при условии критической оценки результатов исследования, можно использовать сведения о значениях артериального давления во время сна, полученные с помощью этого простого в применении метода.
Наличие преимущественно ночных нарушения ритма сердца и проводимости считается одним из клинических маркеров СОАС. Особенно характерна связанная с эпизодами апноэ синусовая аритмия. Так что если при холтеровском мониторировании выявлены повторяющиеся эпизоды брадитахикардии, которая возникает только во время сна, в то время как в состоянии бодрствования пациент демонстрирует нормальную частоту сердечных сокращений или склонность к тахикардии, то это позволяет предполагать СОАС с достаточно высокой степенью вероятности (рис.14). Однако необходимо помнить, что у части больных эти явления могут быть выражены столь незначительно, что оказываются практически неразличимы визуально или, реже, вообще отсутствуют.
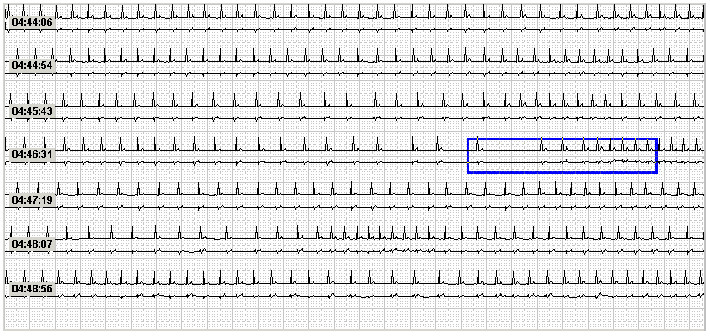
Рис. 14. Холтеровское мониторирование у пациента с СОАС. Связанная с эпизодами обструктивного апноэ синусовая аритмия во время сна. Первоначально в клинике высказывалось предположение о наличии у него синдрома слабости синусового узла.
Из имеющихся в арсенале врача‑интерниста методов инструментального исследования наиболее полезным для выявления СОАС является пульсоксиметрия во время сна. Пульсоксиметрическое мониторирование позволяет зарегистрировать связанную с обструктивными нарушениями дыхания гипоксемию. Данные изменения бывают настолько характерны (рис. 15), что на определенном этапе Британское торакальное общество официально рекомендовало пульсоксиметрический мониторинг в качестве скринингового метода при диагностике СОАС.
Рис. 15. Пульсоксиметрическое мониторирование у больного с тяжелым СОАС (фрагмент записи длительностью 30 мин.). Видны множественные циклически повторяющиеся эпизоды десатураци, вызываемые обструктивными апноэ.
Однако, так как выраженность развивающейся гипоксемии зависит от многих факторов, СОАС в ряде случаев может вообще не сопровождаться сколько‑нибудь заметной десатурацией и в этом случае не может быть выявлен с помощью пульсоксиметрии. Таким образом отсутствие значимых изменений сатурации не позволяет однозначно исключить обструктивные нарушения дыхания во время сна, хотя и делает их наличие менее вероятным.
Интерпретация данных, полученных посредством пульсоксиметрии во время сна значительно зависит от того, какие критерии используются для определения результатов исследования. Принципиально методы анализа полученных данных можно разделить на “количественный” и “качественный”. Первый подразумевает подсчет эпизодов десатурации со снижением SatO2 на 4% и более. При таком способе оценки тест обеспечивает очень высокую специфичность, но не очень хорошую чувствительность. “Качественный” подход к интерпретации результатов исследования предполагает учет любых циклически повторяющихся эпизодов десатурации вне зависимости от их выраженности. Данный метод анализа напротив демонстрирует весьма высокую чувствительность при более низкой специфичности. Следует иметь ввиду, что при измерении сатурации кислорода в диапазоне от 80 до 100% большинство пульсоксиметров дают погрешность измерения до 2%, т.е. снижение SatO2 на 1‑2% может носить случайный характер.
Мы в практической деятельности рекомендуем использовать комбинацию обоих методов оценки данных пульсоксиметрического мониторинга, что в итоге позволяет разделить обследованных больных на три группы – пациентов с высоко вероятным СОАС, возможным СОАС и тех, у кого обструктивные нарушения дыхания во время сна менее вероятны. Для первых характерно наличие циклически повторяющиеся эпизодов десатурации со снижением SatO2 на 4% и более с частотой, превышающей 5 в час. Во втором случае наблюдаются повторяющиеся эпизоды падения сатурации на 2‑4% со средней частотой более 5 в час. И наконец в последней группе имеют место редкие спорадические эпизоды десатурации оксигемоглобина или значимые изменения сатурации во время сна вообще отсутствуют.
Для центральной формы сонного апноэ также характерны повторяющиеся эпизоды десатурации. Выраженность гипоксемии в этом случае обычно оказывается сравнительно меньшей, чем у больных с СОАС, что на практике, однако, служит плохим дифференциально‑диагностическим признаком. Хотя центральные апноэ встречаются существенно реже обструктивных, у больных с патологией, обуславливающей высокий риск нарушений дыхания центрального генеза (в первую очередь речь идет о застойной сердечной недостаточности, остром нарушении мозгового кровообращения и нейромышечных заболеваниях) интерпретация полученных посредством пульсоксиметрии данных оказывается затруднительной, а результат – недостоверным.
Обструктивные и рестриктивные заболевания органов дыхания также могут вызывать периодические снижения насыщения крови кислородом во время сна. Но в этом случае ошибиться гораздо сложнее, так как такие эпизоды десатурации характеризуются большой длительностью и отсутствием цикличности.
Для выявления дыхательных расстройств во время сна можно использовать любой стандартный пульсоксиметр с достаточно высокой частотой регистрации данных (каждые 2‑4 сек.), обладающий функцией памяти и возможностью непосредственного ввода данных в персональный компьютер. При этом наличие специально адаптированного программного обеспечения не является обязательным, так как полученные в цифровом виде результаты легко преобразуются с помощью любой из существующих в настоящее время прикладных компьютерных программ с возможностями графического построения. Впрочем в последнее время практически все пульсокиметры с функцией мониторинга комплектуются прикладными программами для компьютерной обработки полученных данных.
В последние годы за рубежом стало не принято рассматривать пульсоксиметрю в качестве самостоятельного способа выявления СОАС из‑за недостаточной по сравнению с современными диагностическими системами информативности результатов такого исследования. Это правило в первую очередь распространяется на специализированные сомнологические подразделения и его соблюдение в этом случае абсолютно справедливо. Конечно пульсоксиметрическое исследование является не самым оптимальным способом диагностики расстройств дыхания во время сна. Однако на сегодняшний день в условиях отечественного терапевтического стационара пульсоксиметрию с учетом имеющихся ограничений на наш взгляд все же можно рассматривать в качестве пусть и не самого точного, зато простого, доступного и, что немаловажно, наиболее дешевого метода первичной диагностики СОАС.
Вопрос о том, можно ли начинать специфическую терапию на основании диагноза, установленного только по результатам пульсоксиметрии мы оставляем открытым, ограничиваясь лишь высказыванием собственного мнения на этот счет. Действительно, существующие на сегодняшний день руководства отводят пульсоксиметрическому мониторированию вспомогательную роль, предполагая, что наличие СОАС формально должно быть обязательно подтверждено с помощью специального исследования. Однако, при условии знания врачом возможностей и недостатков данной методики, пульсоксиметрия во время сна позволяет определиться с высоко вероятным диагнозом более чем в половине случаев. И это будут наиболее тяжелые больные, особенно нуждающиеся в медицинской помощи. Надо понимать, что при существующей в настоящее время нехватке медицинских центров соответствующего профиля, просто рекомендовать своим пациентам плановое обследование у сомнолога означает оставить часть из них вообще без лечения. Необходимо оценить реальную доступность для конкретного больного специализированной медицинской помощи и только после этого принимать взвешенное решение.
 Иллюстрация 2. Кардиореспираторный монитор SOMNOcheck 2 (Weinmann, ФРГ) | На сегодняшний день для диагностики дыхательных расстройств во время сна в практике стационара терапевтического профиля наиболее оправданным представляется использование портативных кардиореспираторных мониторирующих систем, специально разработанных для диагностики нарушений дыхания во время сна (иллюстрация 2). Обычно подобные устройства как минимум регистрируют храп, ороназальный воздушный поток, дыхательные движения, частоту сердечных сокращений и сатурацию кислорода, что в большинстве случаев позволяет поставить окончательный диагноз (рис. 16). |
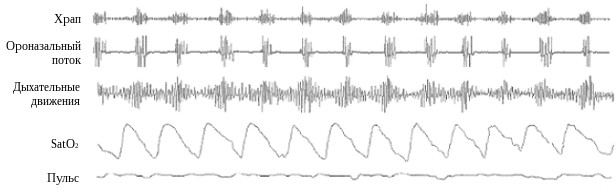
Рис. 16. Кардиореспираторное мониторирование во время сна у больного с СОАС (фрагмент записи длительностью 10 мин.). Исчезновение респираторного потока происходит на фоне сохраняющихся дыхательных усилий. Восстановление дыхания сопровождается интенсивным храпом.
Следует подчеркнуть, что технические возможности кардиореспираторных мониторирующих систем не позволяют достоверно выявлять эпизоды повышенной сопротивляемости верхних дыхательных путей, так как для этого, в частности, необходима энцефалографическая регистрация реакций активации. Поэтому чтобы избежать гиподиагностики при анализе кардиореспираторной записи с практической точки зрения имеет смысл расширить диагностические критерии гипопноэ. Так в соответствии с определением А. М. Белова (1998) гипопноэ можно считать любое визуально различимое падение амплитуды сигнала на каналах регистрации воздушного потока дыхания и/или дыхательных усилий длительностью не менее 10 секунд в сочетании со снижением SatO2 более чем на 2%. В качестве дополнительных критериев можно использовать сопутствующие такому эпизоду характерные колебания частоты сердечных сокращений и возникающий или усиливающийся после его завершения храп.
При наличии в клинике аппаратуры для кардиореспираторного мониторирования во время сна имеет смысл отказаться от скрининга при помощи пульсоксиметрии в пользу этого метода и сразу проводить пациенту более детализированное обследование.
Преимущества и дифференциально‑диагностические возможности многоканальной диагностической системы наглядно иллюстрирует следующее наблюдение (рис. 17). Исследование проводилось у пациента с жалобами на частые пробуждения, сопровождающиеся непродолжительным ощущением нехватки воздуха. В прошлом перенес тяжелое нарушение мозгового кровообращения. В результате кардиореспираторного мониторирования был выявлен синдром центрального апноэ во сне (вариант с дыханием Чейна‑Стокса). Если в этом случае ориентироваться только на результаты пульсоксиметрии, то возникает риск диагностической ошибки. Впрочем грамотного врача обязательно насторожило бы отсутствие у этого больного храпа. Кроме того, перенесший инсульт пациент попадает в оговоренную нами группу при обследовании которой результат пульсоксиметрического мониторирования заведомо недостаточно информативен.
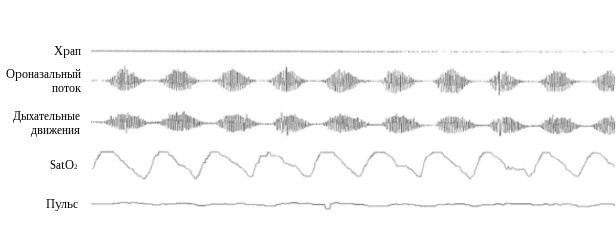
Рис. 17. Кардиореспираторное мониторирование во время сна у больного с дыханием Чейна‑Стокса (фрагмент записи длительностью 10 мин.). Регистрируется специфический “веретенообразный” паттерн дыхания с характерным чередование периодов гипервентиляции, гиповентиляции и апноэ. Отсутствие дыхательных движений во время эпизодов апноэ говорит о их центральном характере.
Анализируя результаты кардиореспираторного мониторирования следует иметь ввиду, что подразделение респираторных событий на обструктивные и центральные только на основании характера дыхательных движений не всегда оказывается точным с клинической точки зрения. Видимое отсутствие дыхательных движений не обязательно означает центральную природу имеющихся нарушений, так как для регистрации слабых дыхательных усилий иногда может просто не хватить чувствительности датчиков. Кроме того, возможна ситуация при которой исчезновение дыхательных усилий рефлекторно возникает в ответ на спадение стенок глотки.
Отдельной проблемой является дифференциальный диагноз гипопноэ обструктивного и центрального характера, так как при гипопноэ любого генеза в той или иной мере присутствуют дыхательные усилия. Одним из маркеров обструктивного характера респираторных эпизодов в этом случае может стать появление так называемого “парадоксального дыхания” – регистрация на каналах дыхательных усилий противофазных движений грудной клетки и живота во время вдоха и выдоха, что является показателем дыхания через суженые верхние дыхательные пути.
Таким образом в ситуации, когда эпизоды апноэ и гипопноэ сочетаются с интенсивным храпом, возникают преимущественно в положении на спине или у больных с выраженным ожирением, всегда существует вероятность, что в их основе лежит обструкция. В диагностически неясных случаях возможно пробное назначение СиПАП‑терапии (см. далее) и если респираторные нарушения в результате эффективно купируются, то это будет свидетельствовать в пользу их преимущественно обструктивного хатактера.
Необходимо учитывать, что в результате обследования могут быть получены и ложноотрицательные результаты. Во‑первых, находясь в условиях медицинского учреждения, больной вынужден соблюдать режим, избегать употребления алкоголя и бесконтрольного приема лекарственных препаратов. Во‑вторых, любое, даже самое на первый взгляд щадящее исследование может приводить к нарушениям сна, качество и длительность которого эта аппаратура контролировать не позволяет. Кроме того, у части больных отмечается достаточно выраженная вариабильность индекса апноэ‑гипопноэ от ночи к ночи, а при наличии феномена повышенного сопротивления верхних дыхательных он может вообще не выходить за границы нормы. Поэтому в ситуации, когда обследование вроде бы не выявило значимых нарушений дыхания во время сна, а клиническое наблюдение тем не менее позволяет предполагать наличие у пациента СОАС, справедливым будет критически подойти к анализу полученных результатов и провести дополнительные исследования.
Еще совсем недавно считалось, что проведение кардиореспираторного мониторинга пациентам с подозрением на СОАС является достаточным с медицинской и оптимальным с экономической точки зрения. На сегодняшний день накапливается все больше знаний о том, что СОАС нередко сочетается с другими нарушениями, ассоциированными со сном, которые могут быть пропущены при использовании только этой методики. Судя по всему через некоторое время кардиореспираторное мониторирование займет нишу первичного скрининга, которую мы в настоящее время отводим пульсоксиметрии, уступив место более сложным и информативным диагностическим процедурам не только в условиях специализированных медицинских подразделений, но и в обычных терапевтических стационарах. Пока же если диагноз остается не вполне ясен или клинический эффект лечения явно недостаточен (например, сохраняется выраженная сонливость), хотя по данным кардиореспираторного мониторирования достигнута формальная нормализация состояния, больной должен быть направлен в специализированный сомнологический центр для проведения полисомнографии.
Полисомнография является “золотым стандартом” в диагностике различных расстройств, связанных со сном. Исследование представляет собой синхронную регистрирацию во время сна электроэнцефалограммы, электроокулограммы, подбородочной электромиограммы, воздушного потока на уровне рта и носа, дыхательных движений живота и грудной клетки, сатурации кислорода, электрокардиограммы и двигательной активности ног. Первые три из вышеперечисленных показателей являются базовыми для идентификации фаз и стадий сна. При этом набор регистрируемых параметров всегда можно расширить, если того требует характер решаемых диагностических задач. Так, например, для более точной оценки дыхательных усилий могут отслеживаться изменения внутрипищеводного давления. Результаты исследования дают очень точную картину различных нарушений, возникающих во время сна, и в том числе позволяют выявить наличие, характер и длительность респираторных эпизодов, сопровождающие их нарушения сердечного ритма и снижение насыщения крови кислородом, а также соотношение всех этих феноменов с фазами сна. Кроме того, только используя полисомнографическую технику, можно объективно оценить избыточную дневную сонливость. Для этого предназначен так называемый множественный тест латенции ко сну. Это стандартизованная диагностическая процедура, в процессе которой пациенту в дневное время несколько раз предоставляется возможность уснуть. Самостоятельного диагностического значения у больных с СОАС данный тест не имеет. Основным показанием к его проведению является подозрение на наличие у пациента нарколепсии.
К сожалению применение полисомнографии у нас пока ограничено высокой стоимостью аппаратуры и нехваткой специалистов, имеющих соответствующую подготовку в этой области. Хотя в последние годы полисомнография перестала быть в нашей стране экзотической и эксклюзивной методикой, количество медицинских учреждений, где могут провести данное исследование, в сравнении с существующими потребностями все еще несоизмеримо мало.
11. ЛЕЧЕНИЕ СОАС
До настоящего времени медицинское сообщество не выработало единого представления о том, каковы клинические показания к началу специфической терапии СОАС.
Исходя из того, что у больных с СОАС при индексе апноэ более 20 существенно возрастает смертность (He J. et al., 1988), многие специалисты руководствуются принципом, что пациенты с индексом апноэ‑гипопноэ более 20 нуждаются в лечении в обязательном порядке, а решение о начале специфической терапии у больных с менее выраженными нарушениями дыхания принимают индивидуализировано, ориентируясь на наличие жалоб или дополнительных факторов риска.
В соответствии с более строгими стандартами, предложенными Американской академией медицины сна, абсолютным показанием к лечению является индекс апноэ‑гипопноэ более 15, а также все случи, когда при индекс апноэ‑гипопноэ более 5 имеется характерная клиническая симптоматики или сопутствующая сердечно‑сосудистая патология.
Остается открытым вопрос о необходимости проводить лечение пациентам молодого и среднего возраста с индексом апноэ‑гипопноэ менее 15‑20 при отсутствии у них жалоб и сердечно‑сосудистых заболеваний или бессимптомным пациентам пожилого возраста вне зависимости от выраженности у них обструктивных нарушений дыхания во время сна.
Подход к лечению СОАС должен быть комплексным (алгоритм 2).
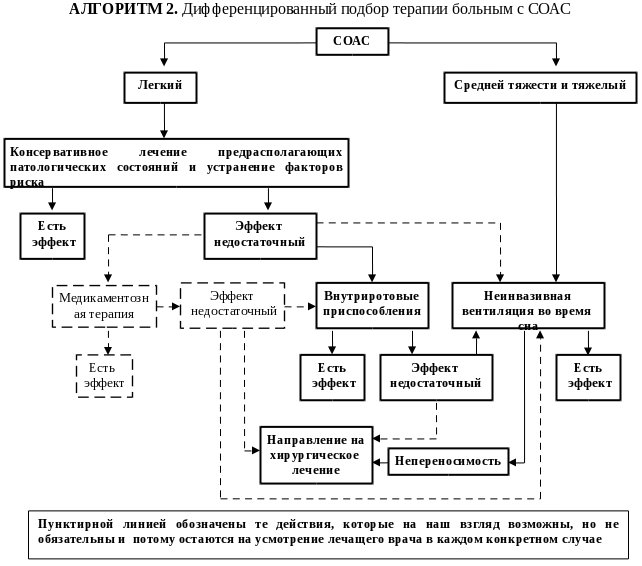
В первую очередь нужно устранить факторы, способные вызвать или утяжелить обструкцию верхних дыхательных путей во время сна. Больной должен максимально уменьшить употребление алкоголя, особенно перед сном, по возможности избегать приема лекарственных средств со снотворным и седативным действием. Данное правило в первую очередь распространяется на широко применяемые на сегодняшний день в клинической практике производные бензодиазепина. Это не означает, что препараты данной группы абсолютно противопоказаны всем пациентам с обструктивными нарушениями дыхания во время сна. Производные бензодиазепина не следует назначать при тяжелом СОАС, особенно – в сочетании с хронической альвеолярной гиповентиляцией. В остальных случаях их назначение должно быть строго обосновано, дозы минимизированы, а сами больные нуждаются в адекватном наблюдении.
Старейшим и самым простым способом коррекции храпа, а следовательно, и СОАС является контроль положения тела в постели. Как один из вариантов, это может быть теннисный мяч, вшитый в заднюю часть ночной сорочки и мешающий пациенту спать на спине. Определенного эффекта также можно добиться, если больной станет спать в полусидящем положении по углом порядка 30‑60$deg;. Понятно, что все это даст результат только в том случае, если имеется значимая зависимость тяжести дыхательных расстройств от позы во время сна.
К сожалению большинство способствующих возникновению СОАС аномалий верхних дыхательных путей носит структурно‑анатомический характер и не подлежит медикаментозному лечению. Тем не менее следует уделить достаточное внимание возможной консервативной терапии ЛОР‑патологии. В первую очередь речь идет о нарушении дыхания через нос у больных с хроническими ринитами, хроническими воспалительными заболеваниями носа и околоносовых пазух. В ряде случаев проблему затрудненного носового дыхания во время сна может решить внешний расширитель носа. Это гибкая пластинка, которая крепится в области крыльев носа наподобие лейкопластыря и расширяет носовые ходы за счет собственной упругости, облегчая тем самым пассаж воздуха.
Нужно проводить активные мероприятия, направленные на коррекцию ожирения, так как иногда одного лишь значительного похудения может оказаться вполне достаточно для устранения СОАС. Даже небольшая потеря массы тела может сыграть свою положительную роль, а снижение веса на 10% от исходного приводит к уменьшению индекса апно‑гипопноэ в среднем на треть. Данное правило естественно не распространяется на пациентов с СОАС без ожирения. Отсутствие эффекта от похудения может означать, что для данного больного достигнутая степень снижения веса просто недостаточна или в генезе СОАС у него ведущую роль играют какие‑то другие факторы.
Не смотря на то, что существует категория больных у которых снижение веса не приводит к уменьшению тяжести СОАС, всем пациентам с ожирением необходимо настоятельно рекомендовать снижение веса тела. В любом случае похудение положительно скажется на состоянии их здоровья в целом, даже если это не приведет к уменьшению тяжести дыхательных нарушений во время сна.
Современные взгляды на лечение ожирения предполагают комплексный подход, включающий изменение образа жизни, диетические мероприятия, фармакотерапию и в ряде случаев – хирургическое пособие. К сожалению консервативные мероприятия, направленные на снижения веса, у этой категории пациентов часто оказываются далеко не так эффективны, как этого хотелось бы. Как уже говорилось выше, ожирение нередко является не только причиной, но и следствием СОАС, поэтому многие больные просто не в состоянии похудеть, пока у них не устранены нарушения дыхания во время сна. Хирургическая коррекция ожирения, напротив, обычно дает хорошие результаты по снижению веса. Однако целесообразность такого подхода к лечению СОАС на наш взгляд представляется достаточно спорной, в том числе из‑за высокого риска различных осложнений при хирургическом вмешательстве у этой категории пациентов. Не отрицая данного метода лечения как такового, мы предлагаем несколько по иному расставлять акценты. В своей практике мы исходим из того, что бариатрическая хирургия является методом выбора при лечении морбидного ожирения, а не способом коррекции СОАС. Наличие СОАС необходимо обязательно учитывать, но не ставить во главу угла при принятии решения о проведении корригирующей вес операции.
Хотя устранение гипоксемии во время сна является одной из основных задач, которые приходится решать в процессе коррекции СОАС, применение оксигенотерапии в качестве самостоятельного метода лечения у этих больных на сегодняшний день считается неоправданным, поскольку она не приводит к исчезновению обструктивных нарушений дыхания во время сна. В ряде исследований было показано, что хотя назначение кислорода в той или иной степени предотвращает связанную с апноэ и гипопноэ гипоксемию, но при этом может увеличиваться длительность самих эпизодов, возникать гиперкапния и ацидоз. Хотя общее количество респираторных событий при дыхании кислородом во время сна в ряде случаев несколько уменьшается, эти изменения в конечном счете не достигают уровня клинической значимости.
Включение кислородотерапии в комплексное лечение больных с СОАС в первую очередь показано пациентам, у которых на фоне проводимой вспомогательной вентиляции во время сна сохраняются выраженные явления гипоксемии. По мнению некоторых авторов ночная оксигенотерапия может стать методом выбора для небольшого числа асимптоматичных пациентов, у которых имеющееся небольшое число обструктивных эпизодов сочетается со значимой гипоксемией во время сна, особенно при наличии дополнительных сердечно‑сосудистых факторов риска.
Медикаментозная терапия
Несмотря на то, что идея медикаментозной коррекции СОАС выглядит очень привлекательной со всех точек зрения, с сожалением приходится признать, что неоднократно предпринимавшиеся в этом направлении усилия врачей и фармакологов пока не увенчались успехом.
Лечение гипотиреоза благоприятно сказывается на течении СОАС, но сравнительно редко приводит к достаточному с клинической точки зрения результату. Полное излечение от обструктивных нарушений дыхания во время сна по всей видимости можно ожидать только у отдельных пациентов с исходно тяжелой гипофункцией щитовидной железы.
Заместительная терапия половыми гормонами несколько уменьшает выраженность обструктивных нарушений дыхания во время сна у пациенток в менопаузе. К сожалению в ходе ряда крупных исследований (HERS‑II и WHI) не только не удалось доказать кардиопротективный эффект заместительной гормональной терапии у женщин, но и был показан сопряженный с таким лечением риск венозных тромбозов и легочной эмболии, заболеваний желчного пузыря и рака молочной железы. Иными словами, риск гормональной терапии может превысить пользу от нее. Поэтому навряд ли имеет смысл длительно проводить подобную терапию при заболевании для которого имеются другие более эффективные методы лечения.
Адекватная фармакотерапия правосердечной недостаточности часто приводит к уменьшению тяжести СОАС, что вероятно обусловлено исчезновением отеков.
Эффективное средство для специфической лекарственной терапии обструктивных нарушений дыхания во время сна не найдено. В качестве препаратов, обладающих ограниченной терапевтической эффективностью, в литературе на сегодняшний день упоминаются некоторые антидепрессанты, медроксипрогестерон, ацетазоламид, теофиллин и модафинил.
Протриптилин – это не оказывающий седативного действия трициклический антидепрессант. Показано, что его применение может привести к некоторому сокращению числа и продолжительности эпизодов апноэ и гипопноэ у больных с СОАС. Это происходит в результате сокращения длительности фазы быстрого сна, во время которой обычно наблюдается наибольшая частота и длительность эпизодов апноэ, а также за счет повышения активности мышц, контролирующих расширение верхних дыхательных путей. У некоторых пациентов терапия протриптилином приводит к исчезновению гипнагогических галлюцинаций, ощущения опьяненности сном и к уменьшению дневной сонливости, даже в том случае, когда количество респираторных эпизодов во время сна заметно не изменяется. К сожалению, в значительном числе случаев результат такого лечения оказывается недостаточным. Впрочем в отсутствии протриптилина на отечественном рынке лекарственных препаратов данная информация представляет преимущественно теоретический интерес.
Хотя другие трициклические антидепрессанты по всей видимости обладают сравнимой с протриптилином способностью предотвращать обструкцию верхних дыхательных путей во время сна, для лечения СОАС их практически не используют, так как в отличие от последнего они потенциально могут усугубить имеющуюся у этих больных дневную сонливость. Кроме того, терапия любыми трициклическими антидепрессантами часто сопровождается широким спектром побочных эффектов, наиболее значимыми из которых применительно к больным с СОАС являются кардиотоксическое действие и увеличение веса тела.
Антидепрессанты из группы ингибиторов обратного захвата серотонина флуоксетин и пароксетин также могут умеренно уменьшать выраженность дыхательных нарушений во время сна у пациентов с СОАС. Кроме того флуоксетин часто понижает дневную сонливость вне зависимости от своего воздействия на качество сна.
Ацетазоламид (диакарб) – диуретик, ингибирующий карбоангидразу, вызывает метаболический ацидоз и оказывает за счет этого стимулирующий дыхание эффект. Он нашел применение при лечении центральных форм сонного апноэ. Несмотря на отдельные обнадеживающие сообщения, клиническая эффективность этого препарат применительно к больным с СОАС большинству специалистов представляется достаточно сомнительной. Кроме того, лечение диакарбом часто сопровождается такими побочными эффектами, как сухость во рту, парестезии, сонливость.
Препараты прогестерона стимулируют дыхание, повышая чувствительность дыхательного центра к СО2. Полагалось, что именно с уровнем прогестерона может быть связана низкая распространенность обструктивных нарушений дыхания во время сна среди женщин. Однако оказалось, что терапия медроксипрогестероном у больных с СОАС не приводит к улучшению. Учитывая результативность применения медроксипрогестерона при лечении альвеолярной гиповентиляции на фоне ожирения, препарат, вероятно, показан пациентам с сочетанием СОАС и дыхательных расстройств центрального генеза и неэффективен при отсутствии гиперкапнии в состоянии бодрствования. Применение прогестерона может приводить к серьезным побочным реакциям, включая импотенцию, венозные тромбозы и тромбоэмболию.
Наряду с бронхорасширяющим эффектом теофиллин оказывает стимулирующее влияние на дыхательный центр и тонизирует дыхательную мускулатуру. В то время как терапия пролонгированными препаратами теофиллина нередко улучшает состояние пациентов с центральными формами апноэ во сне, их применение при СОАС оказалось малоэффективным.
Модафинил4 является стимулятором центральной нервной системы с оригинальным и не до конца понятным механизмом действия и изначально предназначен для лечения заболеваний, сопровождающихся избыточной сонливостью. В отличие от своих амфетаминовых предшественников модафинил хорошо переносится и обладает минимальным числом побочных эффектов. Этот препарат никак не влияет на выраженность дыхательных нарушений во время сна и не должен подменять собой патогенетическую терапию СОАС. Основным показанием к его назначению пациентам с обструктивными нарушениями дыхания во время сна является сохраняющаяся на фоне адекватно подобранного лечения дневная сонливость.
Попытки медикаментозного лечения СОАС в подавляющем большинстве случаев не приводят к достаточному с клинической точки зрения результату. Соответственно, лекарственная терапия может назначаться только в наиболее легких случаях или в сочетании с другими лечебными мероприятиями с целью повышения их эффективности. Представляется наиболее рациональным применять фармацевтические препараты в качестве средств “двойного назначения”, т.е. выбор лекарства и его доза должны быть обусловлены наличием у больного другой сопутствующей патологии, а не имеющимися у него обструктивными нарушениями дыхания во время сна.
Создание положительного давления в дыхательных путях
В 1981 году C. E. Sullivan предложил использовать для лечения СОАС режим дыхания с постоянным положительным давлением во время сна. Данный метод, а вместе с ним и аппарат, получили название СиПАП5.
Суть лечения заключается в том, что портативный компрессор подает пациенту воздух под постоянным положительным давлением и тот играет роль пневматического каркаса, предупреждающего смыкание верхних дыхательных путей во время сна (рис.18).
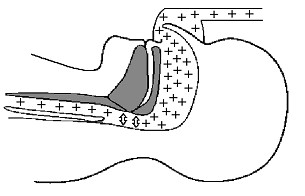
Рис. 18. Механизм лечебного воздействия СиПАП‑терапии (пояснения в тексте).
Больной подключается к дыхательному контуру при помощи масок различных модификаций – закрывающих только нос, одновременно рот и нос или носовых вкладышей, которые закрепляются на лице при помощи специальных ремней. Для удаления выдыхаемой углекислоты создается постоянная небольшая утечка воздуха через отверстие в маске или через специальный клапан. Маска соединяется с аппаратом при помощи гибкого воздуховодного шланга.
Одним из направлений развития СиПАП‑терапии явилась разработка аппаратов Авто‑СиПАП – приборов с функцией автоматического подбора необходимой величины давления в зависимости от наличия и выраженности расстройств дыхания во время сна. В основе используемых лечебных алгоритмов лежит контроль за такими параметрами как храп, ограничение воздушного потока, апноэ и гипопноэ. Величина давления воздуха, которое необходимо пациенту для устранения обструкции верхних дыхательных путей, не является постоянной величиной и зависит от положения тела и фазы сна. Поэтому среднее давление при использовании Авто‑СиПАПа нередко оказывается на 30‑40% меньше по сравнению с фиксированным. Кроме того, аппаратура с автоматической настройкой в отличие от традиционных устройств позволяет отслеживать изменения тяжести обструктивных нарушений дыхания во время сна в случаях употребления алкоголя или прибавки веса. Таким образом, аппараты Авто‑СиПАП обеспечивают лишь то давление, которое реально необходимо пациенту, что на практике позволяет сочетать максимальную эффективность и переносимость лечения. Не смотря на то, что процесс автоматического титрования давления косвенно подтверждает наличие обструктивных нарушений дыхания во время сна, тест‑терапия с использованием Авто‑СиПАПа не должна подменять стандартные диагностические процедуры.
 Иллюстрация 3. Авто-СиПАП SOMNOsmart 2 со съемным увлажнителем SOMNOclic (Weinmann, ФРГ) | Для лучшего понимания процессов, лежащих в основе автоматического титрования давления, рассмотрим в качестве примера принцип работы Авто‑СиПАПа SOMNOsmart 2 (Weinmann, ФРГ) (иллюстрация 3). Лечебный алгоритм аппарата основывается на одновременной регистрации и оценке трех различных параметров – дыхательного потока, храпа и так называемого OPS‑сигнала6. |
При работе аппарата осуществляется анализ респираторного потока, изменения объема и формы которого позволяют судить о наличии и степени обструкции. Одновременно генерируются низкоамплитудные воздушные колебания (OPS) и на основании изменений отраженного сигнала определяется проходимость верхних дыхательных путей. Кроме того, при анализе кривой воздушного потока отслеживается наличие специфической частотной составляющей, характерной для храпа.
В ходе анализа параметров воздушного потока устройством выявлются храп, гипопноэ и апноэ. По амплитуде отраженного OPS‑сигнала оценивается степень раскрытия верхних дыхательных путей. В комплексе это позволяет не только выявлять даже незначительные уменьшения просвета верхних дыхательных путей, но и дифференцировать обструктивную и центральную природу респираторных событий.
Только на основании суммарной оценки всех этих параметров делается заключение о наличии обструкции верхних дыхательных путей и производится соответствующая коррекция уровня лечебного давления. Благодаря комплексному анализу респираторных событий становится возможным не только различать характер имеющихся нарушений, но и избежать ошибочных изменений уровня лечебного давления, провоцируемых такими артефактами, как утечки воздуха, гипервентиляции, глотание или кашель.
Хотя на сегодняшний день среди специалистов нет единого мнения о роли и месте приборов Авто‑СиПАП в лечении обструктивных нарушений дыхания во время сна в сравнении с традиционными аппаратами, эти устройства уже достигли той степени технического совершенства, когда их можно смело рекомендовать для широкого использования.
В настоящее время не рекомендуется применять автоматические аппараты для лечения СОАС у больных с застойной сердечной недостаточностью, тяжелыми хроническими заболеваниями легких, ночной гипоксемией, не связанной с обструктивными нарушениями дыхания (например, при альвеолярной гиповентиляции на фоне ожирения). Кроме того, у пациентов, которые не храпят после операции на мягком нёбе или по другим причинам, не следует проводить лечение с использованием приборов, алгоритм работы которых основывается на выявлении звуковой составляющей или вибрации дыхательных путей.
На наш взгляд автоматические устройства в первую очередь показаны пациентам со значительной вариабельностью необходимой им величины давления, особенно если для лечения обструктивных нарушений дыхания во время сна им требуется высокое (более 12 см водного столба) давление воздуха.
Для устранения обструкции верхних дыхательных путей во время вдоха необходимо более высокое давление, чем на выдохе. Это позволяет использовать для лечения СОАС системы, создающие два разных уровня положительного давления на вдохе и выдохе – БиПАП7. При этом смена более высокого инспираторного давления на более низкое экспираторное и обратно обусловлены дыхательными усилиями самого больного. Давление вдоха генерируется в ответ на создаваемый пациентом собственный инспираторный поток и переключается на давление выдоха, когда инспираторный поток падает ниже определенного уровня. В аппаратах БиПАП разница между давлением вдоха и выдоха может варьировать в весьма широком диапазоне, достигая 15‑20 см водного столба.
Аппараты данного типа применяются при субъективной непереносимости пациентом высокого давления на выдохе, а также у больных с сочетанием СОАС и хронической дыхательной недостаточности.
Современные аппараты СиПАП портативны, имеют малый вес и отличаются низким уровнем шума. Чтобы облегчить пациенту процесс засыпания, существует индивидуально регулируемая опция постепенного повышения давления до лечебного уровня. При необходимости эти приборы могут быть оснащены приставкой для увлажнения и подогрева вдыхаемого воздуха, которая включается непосредственно в контур аппарата. Степень нагрева подбирается индивидуально в зависимости от температуры окружающего воздуха и собственных ощущений пациента. Чрезмерный нагрев жидкости не желателен, так как приводит к скоплению конденсата в маске и может ухудшить переносимость терапии. Основным показанием к использованию увлажнителя являются побочные эффекты, связанные с раздражением слизистой носа и ротоглотки потоком воздуха.
Основными показаниями для начала СиПАП‑терапии являются средней тяжести и тяжелый СОАС. У пациентов с СОАС легкого течения решение о начале лечения принимается индивидуально. Для коррекции неосложненного храпа СиПАП не используется.
Данная методика носит компенсаторный характер, т.е. не ведет к излечению СОАС и поэтому должна применяться на постоянной основе. Исключение составляют случаи, когда устранение дыхательных нарушений во время сна в последующем приводит к значительному снижению веса тела.
Оптимальным является проведение СиПАП‑терапии каждую ночь и в течение всего времени сна. Адекватным лечением условно принято считать использование СиПАП в течение не менее 4‑5 часов за ночь не менее 5 дней в неделю. Хотя после прекращения лечения определенный эффект последействия обычно сохраняется еще несколько суток, полная отмена СиПАП‑терапии ведет к скорому рецидиву.
Абсолютных противопоказаний к лечению СОАС методами вспомогательной вентиляции во время сна не существует. С осторожностью рекомендуется проводить терапию у пациентов с пневмотораксом, пневмоцефалией или пневмомедастинумом в анамнезе, с буллезной эмфиземой легких, рецидивирующими синуситами и глазными инфекциями, хроническими воспалительными заболеваниями ушей, с частыми носовыми кровотечениями, при наличии в прошлом хирургических вмешательств на головном мозге, среднем или внутреннем ухе.
Качество терапии и последующая переносимость лечения во многом зависят от правильного подбора маски. Все маски и воздуховоды имеют стандартные разъемы и поэтому полностью совместимы друг с другом. Поэтому желательно, чтобы в распоряжении врача были маски не только разных типов и размеров, но и от разных производителей, так как даже незначительные конструктивные отличия в ряде случаев определяют субъективную комфортность для пациента. Задача состоит в том, чтобы подобрать наиболее герметичную при контакте с лицом и при этом удобную для больного маску. Следует выбрать наименьший возможный размер при котором не происходит сдавления носа и ухудшение носового дыхания. Правильность выбора маски и ее фиксации на лице следует проверить пока больной бодрствует, дав на короткое время нагрузку давлением порядка 10 см водного столба.
Подбор необходимой величины давления воздуха осуществляется эмпирически, ориентируясь на клиническую эффективность и субъективную переносимость. Задачей является достигнуть исчезновения апноэ, гипопноэ и храпа, добиться нормализации структуры сна и газового состава крови (рис. 19). Сохраняющийся храп является признаком неустраненной обструкции и неадекватного уровня давления воздуха, даже если при этом не регистрируются изменения воздушного потока и десатурация оксигемоглобина.
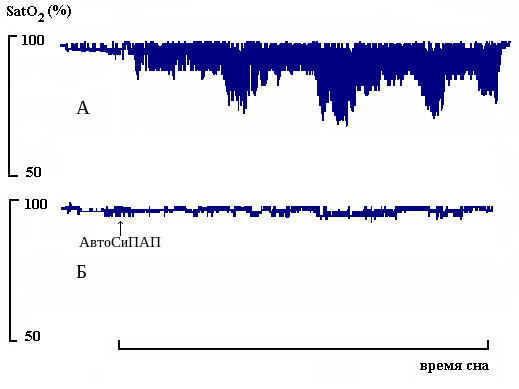
Рис. 19. Пульсоксиметрия во время сна у пациента с тяжелым СОАС исходно (А) и на фоне СиПАП‑терапии (Б).
Наименьший уровень давления воздуха, предусмотренный в большинстве современных аппаратов для СиПАП‑терапии составляет 4 см водного столба. Соответственно подбор режима СиПАП начинают с минимального комфортного для больного давления (обычно составляющего порядка 4‑6 см водного столба), которое после засыпания пациента ступенчато повышают на 1‑2 см каждые 10‑15 минут. Следует остановиться на минимальном давлении, которое эффективно устраняет обструкцию верхних дыхательных путей во всех положениях тела и в течение всего времени сна. Давление воздуха в диапазоне от 8 до 12 см водного столба оказывается достаточным для значительной части больных и в этих пределах обычно удовлетворительно переносится. Пациентам с тяжелой формой СОАС в ряде случаев требуется существенно более высокое давления воздуха для того, чтобы полностью устранить обструктивные нарушения дыхания. Однако, при таком уровне давления нередко значительно затрудняется выдох и нарушается сон, что может стать причиной отказа больного от лечения. В подобной ситуации по нашим наблюдениям у некоторых больных удается добиться лучшей переносимости высокого давления при смене носовой маски на ротоносовую. В противном случае имеет смысл снизить величину давления до субъективно приемлемой, так как польза от хорошей переносимости терапии обычно превышает негативные последствия от сохраняющихся в незначительном количестве обструктивных явлений. Если же терапевтический эффект после такого уменьшения давления оказывается неудовлетворительным, то адекватной альтернативой становится переход к использованию БиПАП – системы с двумя уровнями положительного давления. В качестве промежуточного решения могут выступать некорые современные СиПАП‑аппараты, обладающие опцией снижения давления на выдохе. Такой алгоритм напоминает режим двухуровневой вентиляции, но в отличие от классического БиПАП предусматривает разницу между давлением вдоха и выдоха не более 3 см водного столба.
Существенно упростить подбор терапии можно используя Авто‑СиПАП. В ряде исследований было показано, что при определении необходимой пациенту величины давления с помощью аппаратов с автоматической настройкой результат обычно бывает аналогичен тому, который достигается в ходе подбора лечения с участием медицинского персонала. Тем не менее и в этом случае эффективность начатой терапии необходимо проконтролировать с помощью кардиореспираторного монитора или хотя бы пульсоксиметра.
При подборе БиПАП‑терапии вначале добиваются устранения эпизодов апноэ при одинаковой величине давления на вдохе и выдохе. Это условие обусловлено алгоритмом работы аппарата в соответствии с которым положительное давление вдоха генерируется только при наличии хотя бы небольшого собственного инспираторного потока. Затем продолжают повышать давление вдоха до исчезновения эпизодов гипопноэ, храпа и гипоксемии. В результате инспираторное давление оказывается больше экспираторного. Обычно при лечении СОАС эта разница составляет порядка 5 см водного столба, но при сочетании обструктивных нарушений с дыхательной недостаточностью другого генеза может достигать 10 см водного столба и даже более.
Иногда после начала лечения вместо исчезнувших обструктивных возникают преходящие центральные апноэ и гипопноэ. Вероятно это связано с временными процессами торможения в дыхательном центре, который был адаптирован к условиям гипоксемии и гиперкапнии и не успел приспособиться к быстро нормализовавшемуся газообмену. Эти центральные нарушения дыхания в дальнейшем обычно исчезают самостоятельно и повышение давления воздуха при этом не показано.
Традиционно используется несколько альтернативных схем подбора терапии. Чаще всего применяется титрование давления в течение одной полной ночи, после того как одна из предыдущих ночей была посвящена диагностике.
Другим вариантом подбора лечебного режима является методика “разделенной ночи”, когда диагностика СОАС и титрование давления последовательно осуществляются в течение одной ночи. Данный способ может быть рекомендован для пациентов с наиболее тяжелыми и, следовательно, опасными формами расстройств дыхания во время сна.
Теоретически первичный подбор СиПАП‑терапии можно проводить и во время дневного сна. На наш взгляд подобная тактика может оказаться оправдана у отдельных пациентов с тяжелым СОАС и однозначно не показана больным с умеренно выраженными нарушениями дыхания. При этом пациенту в дальнейшем может потребоваться дополнительная коррекция уровня давления воздуха.
На практике можно столкнуться с ситуацией, когда после начала лечения у пациента сохраняются дневная сонливость или другие свойственные СОАС симптомы. При этом речь может идти как о плохой приемлемости, так и о недостаточной эффективности лечения. Большинство современных аппаратов для СиПАП‑терапии позволяет отслеживать реальную длительность и время их использования. Если средняя продолжительность лечения в течение ночи оказывается небольшой, то усилия врача должны быть направлены на улучшение приемлемости терапии. Если же продолжительность использования аппарата достаточно высока, то необходимо оценить возможные причины низкой эффективности лечения.
Когда речь идет о амбулаторном пациенте, использующем аппарат СиПАП с фиксированным уровнем лечебного давления, необходимо исключить возможные отягощающие факторы, такие как регулярное злоупотребление алкоголем.
Еще одной причиной недостаточной эффективность СиПАП‑терапии, проводимой как с помощью традиционных, так и автоматических устройств, может стать утечка воздуха из‑под маски. Обычно это происходит в результате неправильного подбора модели и размера маски или ее недостаточно плотной фиксации на лице. Борьба с такими потерями воздуха не должна превращаться в самоцель, так как современные аппараты для СиПАП‑терапии способны отслеживать давление в контуре и самостоятельно компенсировать небольшие утечки воздуха. Если утечка не постоянная и не велика, то такими потерями воздуха можно пренебречь. Небольшая по объему утечка требует обязательного устранения лишь в том случае, когда выходящая из‑под маски струя воздуха направлена в глаза.
Другим распространенным вариантом утечки является стравливание воздуха через рот. Основными причинами таких утечек являются высокий уровень лечебного давления и затруднение носового дыхания. Кроме того сон на спине является дополнительным фактором, способствующим появлению утечек через рот, так как в этом положении нижняя челюсть может смещаться вниз под действием силы тяжести, что способствует открыванию рта и сбросу воздуха. Для устранения утечек через рот можно использовать специальные ремни, фиксирующие нижнюю челюсть в закрытом положении, или перейти на ротоносовую маску.
Многие современные аппараты способны регистрировать и сохранять в памяти данные о наличии и объеме утечек, что существенно облегчает врачу анализ ситуации.
После того, как исключены возможные причины неэффективного лечения следует провести контрольное исследование и оценить правильность подбора лечебного режима. Если оказывается, что дыхательные нарушения во время сна формально устранены, а пациента все равно продолжает предъявлять свойственные СОАС жалобы, имеет смысл повысить давление в аппарате на 2‑3 см водного столба и оценить последующий эффект. Если это все равно не приводит к адекватному клиническому результату, то следует сосредоточить внимание на выявлении других патологических состояний, способных вызывать аналогичные жалобы.
Следует отметить, что хотя для диагностики и последующего подбора СиПАП‑терапии в принципе бывает достаточно от одной до трех ночей, которые пациент проводит в лечебном учреждении, опыт показывает, что период первичной адаптации к лечению обычно занимает около недели. За это время удается не только при необходимости скорректировать лечебный режим, но также окончательно подобрать оптимальные для пациента тип и размер маски, привить ему навыки пользования лечебной аппаратурой. Показано, что правильное обучение пациента во многом предопределяет дальнейшее соблюдение им адекватного режима лечения. В связи с отсутствием в нашей стране соответствующей патронажной службы по оказанию больным с СОАС консультативной помощи и контролю проведения СиПАП‑терапии на дому эти функции автоматически возлагаются на лечащего врача, что в ряде случаев делает желательным проведение этого адаптационного периода в больничных условиях. Меньшая стоимость лечения пациента в терапевтическом стационаре по сравнению со специализированными центрами, а также наличие у большинства больных с СОАС различной сопутствующей патологии внутренних органов, часто требующей активной медикаментозной коррекции, делают такое или даже более длительное пребывание под врачебным наблюдением вполне оправданным.
Терапия с использованием аппаратуры для вспомогательной вентиляции во время сна может сопровождаться определенными нежелательными явлениями.
Наиболее частыми осложнениями являются раздражение и потертости кожи лица, вызванные маской, сухость слизистых носа и ротоглотки, заложенность носа или ринорея и раздражение глаз. Причинами этих явлений нередко становятся неправильный подбор маски, недостаточно плотная или, наоборот, слишком сильная фиксация ее на лице, утечки воздуха и высокий уровень лечебного давления. Благодаря использованию современных масок разных конструкций и с большим диапазоном размеров, увлажнителей и аппаратов с автоматической настройкой давления эти явления обычно носят преходящий характер и не являются основанием к прекращению лечения. У пациентов с выраженными стойкими нарушениями носового дыхания часто оказывается предпочтительной ротоносовая маска. Больным с ринореей могут помочь интраназальные ингаляции ипратропиума бромида.
У некоторых пациентов применение масок вызывает клаустрофобическую реакцию, что может стать значительным препятствием к проведению СиПАП‑терапии. С целью преодоления такой ситуации разными специалистами рекомендуется на начальных этапах адаптации к лечению большой диапазон мероприятий начиная с назначения небензодиазепиновых снотворных и анксиолитиков и заканчивая процедурой десенситизации т.е. постепенному привыканию к маске в дневные часы. В ряде случаев больными этой категории лучше переносятся носовые вкладыши, так как они в меньшей степени создают у них ощущение замкнутого пространства.
Более серьезные проблемы, такие как аэрофагия, конъюнктивит, гайморит, отит или носовое кровотечение встречаются достаточно редко. Опасные побочные явления при проведении СиПАП‑терапии обычно не возникают. В литературе встречаются описания лишь единичных клинических случаев, когда СиПАП‑терапия сопровождалась такими осложнениями, как пневмоцефалия, превмомедиастинум, бактериальный менингит, нарушения сердечного ритма или массивное носовое кровотечение. Не известно ни об одном летальном исходе в результате проведения вспомогательной вентиляции у пациентов с СОАС.
Хотя СиПАП‑терапия на сегодняшний день является наиболее эффективным способом коррекции СОАС, более половины пациентов в конечном счете не соблюдает адекватный режим лечения, либо вообще отказывается от него. Это может быть вызвано нежеланием лечиться постоянно, побочными эффектами, физическим и психологическим дискомфортом при использовании лечебного оборудования, дороговизной аппаратуры.
Степень наблюдающегося улучшения обычно прямо пропорциональна исходной выраженности симптоматики. Естественно, что, чем больший эффект от терапии бывает получен, с тем большим энтузиазмом стремится продолжить дальнейшее лечение пациент. Соответственно больные с изначально тяжелым СОАС в дальнейшем чаще продолжают регулярно использовать аппарат СиПАП в амбулаторных условиях, а самым надежным контролером для них становится само заболевание, симптомы которого достаточно быстро возвращаются при несоблюдении режима лечения. Если же случай относительно легок и симптоматика исходно выражена незначительно, нередко бывает довольно затруднительно убедить больного в необходимости применять это лечение на постоянной основе, так как в этом случае испытываемый ночью дискомфорт может субъективно перевесить эффект от самого лечения. Кроме того, на долгосрочную приверженность пациента лечению оказывают влияние такие факторы как пол, возраст, образование и трудовая занятость. Лучшую переносимость терапии в перспективе можно ожидать у работающих мужчин среднего возраста с высшим образованием, средним и высоким уровнем доходов, страдающих среднетяжелым или тяжелым СОАС. Тем не менее предсказать долгосрочную приверженность каждого конкретного пациента к лечению бывает весьма затруднительно.
Хирургические методы лечения
На сегодняшний день признанно, что терапией первой линии для большинства пациентов с клинически значимым СОАС является методика СиПАП. В случаях, когда тяжесть имеющихся нарушений дыхания требует их обязательной коррекции, а применение СиПАП‑терапии и других неинвазивных методов по каким‑либо причинам медицинского и социального характера оказалось затруднено или не привело к желаемому результату, больному может быть рекомендовано хирургическое лечение.
Хирургическая коррекция СОАС ставит своей задачей устранение причин, лежащих в основе имеющихся у больных обструтивных нарушений во время сна, то есть по идее направлена на истинное излечение заболевания. Результаты оперативного лечения принято считать успешными в том случае если индекс апноэ‑гипопноэ снижается более чем вдвое от исходного и при этом становится меньше 20. Однако на практике это происходит далеко не всегда, а само лечение может достаточно тяжело переноситься пациентами и не гарантирует от последующих рецидивов. Тем не менее хирургические методы на сегодняшний день являются полноправным средством выбора и занимают свое прочное место в арсенале имеющихся способов борьбы с СОАС.
Любой операции должно предшествовать тщательное обследование больного. Только после того, как будет инструментально подтверждено наличие и установлена тяжесть СОАС, выявлены имеющиеся анатомические аномалии верхних дыхательных путей и уточнена локализация фарингеальной обструкции, принимается индивидуализированное решение о возможности и необходимом объеме хирургического вмешательства. В противном случае эффективность такого лечения может оказаться весьма низкой. Кроме того, следует помнить, что у пациентов с СОАС обезболивание и интубация всегда сопряжены с повышенным риском. Седативные препараты, наркотические аналгетики и средства для наркоза способствуют обструкции верхних дыхательных путей, свойственные этим больных анатомические особенности затрудняют интубацию, а сопутствующая сердечно‑сосудистая патология еще больше увеличивает риск анестезии и оперативного вмешательства.
Идея устранить СОАС, обеспечив поступление воздуха минуя уровень возникновения обструкции принадлежала W. Kuhlo и соавторам (1969). Трахеостомия была первым и достаточно длительное время оставалась единственным по‑настоящему эффективным методом лечения тяжелых форм СОАС. После внедрения в клиническую практику СиПАП‑терапии эта операция утратила свою актуальность. Тем не менее трахеостомия остается единственной хирургической манипуляцией, позволяющей радикально устранять СОАС, и ее следует иметь ввиду при непереносимости СиПАП‑терапии у больных с морбидным ожирением, тяжелой гипоксемией с SatO2 менее 70% во время сна, опасными аритмиями и неконтролируемой артериальной гипертонией.
В отличие от трахеостомии при использовании других хирургических техник для лечения СОАС адекватный результат лишь в отдельных случаях может быть получен в результате какой‑то одной манипуляции. С учетом многофакторной природы возникновения обструктивных нарушений дыхания во время сна, современная стратегия хирургической коррекции СОАС предполагает комплексный и поэтапный подход. Первый этап может включать в себя реконструктивную хирургию носа, увулопалатофарингопластику, оперативные вмешательства на подъязычной кости и ее мышечном аппарате и уменьшение объема языка.
Реконструктивной хирургии носа при лечении СОАС обычно отводится вспомогательная роль. Тем не менее большинство специалистов считает восстановление нормального носового дыхания обязательной первичной процедурой при наличии клинически значимых обструктивных нарушений дыхания во время сна. Кроме того, это может заметно улучшить переносимость проводимой в дальнейшем СиПАП‑терапии.
Увулопалатофарингопластика была предложена S. Fujita и соавторами (1981) в качестве альтернативы трахеостомии у больных с СОАС и направлена на устранение анатомических аномалий ротоглотки. Она включает в себя удаление миндалин, сшивание нёбных дужек и иссечение нёбного язычка с частью мягкого неба. Операция достаточно травматична и поэтому проводится под общим наркозом. Среди возможных осложнений описаны послеоперационное кровотечение, значительный отек тканей с нарушением проходимости верхних дыхательных путей, назальный рефлюкс, назофарингеальный стеноз, гнусавость и даже смертельные исходы. К сожалению увулопалатофарингопластика оказывается достаточно эффективной менее чем у половины прооперированных больных, что особенно характерно для пациентов с выраженным ожирением и тяжелыми формами СОАС. Кроме того, достигнутое в ходе операции улучшение не всегда оказывается стойким.
Сравнительно низкая эффективность увулопалатофарингопластики в сочетании с риском серьезных осложнений привели к тому, что с начала 90‑х годов прошлого века многие хирурги стали отдавать предпочтение близким по своей сути, но более щадящим техникам. В основе этих методов лечения лежит дозированное термическое, радиоволновое, холодовое или химического воздействие на структуры ротоглотки в результате чего происходит уменьшение объема мягкого неба, а нёбный язычок оказывается частично или полностью удален.
Одной из таких процедур является разработанная Y. V. Kamami (1990) лазерная увулопалатопластика. В процессе операции происходит удаление излишков ткани мягкого нёба и нёбного язычка с помощью лазера. Эта манипуляция не столь травматична, как увулопалатофарингопластика, проводиться под местным обезболиванием и не требует госпитализации в стационар, что привело к ее широкому распространению. К сожалению метод оказался эффективен только при неосложненном храпе и наиболее легких формах СОАС и практически бесполезен в случае среднетяжелого или тяжелого течения болезни. При этом у пациента может возникнуть ощущение ложного благополучия, так как громкость храпа после такого вмешательства нередко уменьшается не смотря на то, что тяжесть дыхательных нарушений во время сна остается неизменной. Это дало экспертам Американской академии медицины сна основание официально исключить лазерную увулопалатопластику из перечня хирургических пособий, рекомендуемых для лечения обструктивных нарушений дыхания во время сна. В тех случаях, когда предполагается применение лазерной увулопалатопластики для лечения храпа, пациент в обязательном порядке должен предварительно пройти соответствующее обследование, чтобы исключить наличие обструктивных нарушений дыхания во время сна. Все это в равной степени относится к любым малоинвазивным вмешательствам на мягком небе.
Популярной за рубежом, но пока еще сравнительно мало знакомой отечественным специалистам методикой является сомнопластика. При этом виде оперативного вмешательства уменьшение объема и уплотнение тканей верхних дыхательных путей производится в результате воздействия волн радиочастотного диапазона. Если при использовании лазера рубец образуется на поверхности, то при сомнопластике возникновение участка повреждения и последующее его рубцевание происходят подслизисто в толще тканей. Этот способ лечения прельщает своей простотой и малым числом побочных эффектов. Такое вмешательство менее болезненно и легче переносится, а заживление проходит в более короткие сроки. Многие зарубежные специалисты, занимающихся хирургическим лечении СОАС, в последнее время стали рассматривать сомноплостику в качестве одного из возможных стандартных компонентов первого этапа лечения.
Если обструкция верхних дыхательных путей локализуется на уровне гортаноглотки, их просвет может быть увеличен за счет репозиции или уменьшения объема языка. В первом случае проводятся достаточно сложные оперативные вмешательства на подъязычной кости и ее мышечном аппарате в результате чего подъязычная кость и язык смещаются кпереди и увеличивается расстояние между корнем языка и задней стенкой глотки. Во втором случае происходит частичная резекция корня языка с помощью лазера или уменьшение его объема радиохирургическим методом.
Результаты проведенного на первом этапе хирургического лечения окончательно оцениваются спустя 6 месяцев. При отсутствии удовлетворительного эффекта от проделанных манипуляций рассматривается возможность проведения операции второго этапа. Речь идет о репозиции верхней и нижней челюстей. Это хирургическое вмешательство на костях лицевого скелета, разработанное для устранения челюстно‑лицевых аномалий, может быть с успехом использовано для коррекции СОАС. В ходе операции части нижней и верхней челюстей смещаются кпереди. Основным показанием к данной операции служит предшествующая неэффективность других методов коррекции гипофарингеальной обструкции у пациентов с ретрогнатией. Эффективность этого метода лечения высока, но сложность выполнения операции существенно ограничивает его применение.
Внутриротовые приспособления
Исходя из современного понимания процессов, приводящих к обструкции верхних дыхательных путей у больных с СОАС, создан ряд специальных механических устройств, предотвращающий коллапс глотки во время сна. Использование внутрироротовых аппликаторов на сегодняшний день является одной из стандартных методик, рекомендуемых для лечения обструктивных нарушений дыхания во время сна.
Механические приспособления рассматриваются как возможная альтернатива СиПАП‑терапии или хирургическому лечению и являются методом выбора при легком и среднетяжелом СОАС. Их не следует рассматривать в качестве терапии первой линии у пациентов с тяжелыми обструктивными нарушениями дыхания во время сна. В этом случае следует отдать предпочтение СиПАП‑терапии, которая у таких больных более результативна, или рассмотреть возможность хирургического вмешательства. Однако при недостаточной эффективности или плохой переносимости других методов лечения внутриротовые аппликаторы можно испробовать даже при наличии тяжелого СОАС.
На сегодняшний день существует два принципиально отличающихся по механизму действия типа внутриротовых приспособлений – действующие за счет выдвижения нижней челюсти или по принципу удержания языка. Если в первом случае увеличение просвета верхних дыхательных путей достигается за счет выдвижения нижней челюсти, то во втором предотвращается западение языка во время сна. Кроме того полагают, что ротовые устройства могут уменьшать предрасположенность к глоточному коллапсу за счет возрастающего в результате их использования тонуса мышц верхних дыхательных путей.
Приспособления из серии удержателей языка отдаленно напоминают детскую соску‑пустышку, на конце которой находится специальная эластичная присоска, которая фиксирует язык, не позволяя ему смещаться кзади и предотвращая тем самым обструкцию глотки.
Устройства для репозиции нижней челюсти крепятся на зубах и смещают нижнюю челюсть вместе с языком кпереди, обеспечивая активное расширение верхних дыхательных путей.
Результат подобной терапии может существенно варьировать как у разных больных, так и в зависимости от типа используемого устройства. Механические приспособления чаще оказываются эффективны у пациентов с менее тяжелым СОАС, сравнительно более молодого возраста, без выраженного ожирения и если тяжесть дыхательных нарушений связана у них с положением тела, возрастая во время сна на спине. Эффект от репозиции нижней челюсти во многом зависит от того, в какой степени удается сместить ее кпереди. Устройства для удержания языка предпочтительны у пациентов с макроглоссией, с проблемными зубами или при невозможности осуществить адекватное выдвижение нижней челюсти.
В продаже существуют отдельные уже готовые к использованию модели внутриротовых аппликаторов, конструкция которых теоретически позволяет пациенту регулировать их самостоятельно. Однако оптимальным является индивидуальный подбор и изготовление приспособления для конкретного больного при участие квалифицированного стоматолога. Кроме того, полученный клинический эффект должен быть подтвержден с помощью объективных методов исследования.
Переносимость терапии с использованием ротовых аппликаторов весьма индивидуальна. Нередко больные отмечают выраженный дискомфорт при их использовании и нуждаются в достаточно длительном времени для привыкания. Однако в некоторых случаях внутриротовые приспособления переносятся даже лучше чем СиПАП‑терапия и больные проявляют бóльшую приверженность такому лечению не смотря на то, что формально вспомогательная вентиляция оказывается у них более эффективна.
12. ЗАКЛЮЧЕНИЕ
СОАС не только широко распространенная, но и крайне негативно сказывающаяся на качестве жизни и состоянии здоровья патология. Однако данное заболевание к сожалению все еще недостаточно хорошо известно широкому кругу отечественных практических врачей, и лишь незначительное их число достаточно подготовлены, для того чтобы распознавать и, главное, лечить это расстройство у своих пациентов. Иногда такие больные годами наблюдаются у специалистов разного профиля, не подозревая, что основной причиной их проблем являются нарушения дыхания во время сна.
Для того, чтобы успешно помочь пациенту, страдающему СОАС, необходимо соблюдение ряда условий. Врач должен хорошо знать проблему и, используя имеющиеся в его распоряжении методы обследования, своевременно поставить правильный диагноз, а затем подобрать больному адекватную терапию. Практический опыт показывает, что даже при наличии минимального набора необходимой аппаратуры можно вполне адекватно выявлять и лечить значительную часть больных с СОАС в лечебных учреждениях терапевтического профиля. При этом следует учесть доступность для пациента назначаемой ему терапии и исходить в своих рекомендациях из того перечня процедур, которыми пациент реально сможет воспользоваться. Затем необходимо обучить пациента правильно применять рекомендованные устройства и оказывать ему консультативную помощь в процессе лечения. И наконец сам больной должен активно сотрудничать с лечащим врачом, выполняя его предписания и рекомендации. Тогда в награду за совместные усилия возникает реальная возможность превратить недавнее тяжелое страдание в незначительные особенности образа жизни, сделать сон освежающим, а жизнь полноценной.
1 Альвеолярная гиповентиляция (гиперкапническая форма дыхательной недостаточности) представляет собой уменьшение вентиляции легких и обычно определяется как рСО2 больше 45 мм рт. ст. в покое изолированно или в сочетании с гипоксемией. Под синдромом альвеолярной гиповентиляции при ожирении понимают состояние, характеризующееся гиперкапнической формой хронической дыхательной недостаточности на фоне выраженного ожирения при исключении других возможных причин описываемых нарушений.
2 REM – rapid eye movement; NREM – non‑rapid eye movement (англ.)
3 Приводимый вариант незначительно отличается от англоязычного оригинала, так как был адаптирован нами для отечественных пациентов
4 в России препарат не зарегистрирован
5 СРАР – Сontinuous Positive Airway Pressure (англ.)
6 OPS ‑ Oscillation Pressure Signal (англ.)
7 BPAP ‑ Bilevel Positive Aairway Pressure (англ.).
ОСНОВНАЯ ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
- Белов А.М. Обструктивные нарушения во время сна: методологические основы диагностики, синдром “перекреста”, кардиоваскулярные проявления: Дис. ... д‑ра. мед. наук. – М., 1998.
- Блоцкий А.А., Плужников М.С. Феномен храпа и синдром обструктивного апноэ во сне. – СПб.: СпецЛит, 2002.
- Бузунов Р.В. Лечение синдрома обструктивного апноэ во сне методом создания положительного давления в дыхательных путях. – М., 2004.
- Вейн А.М., Елигулашвили Т.С., Полуэктов М.Г. Синдром апноэ во сне. – М.: Эйдос Медиа, 2002.
- Воронин И.М. Кардиоваскулярные последствия обструктивных нарушений дыхания во время сна. – Тамбов: Изд‑во ТГУ им. Г.Р. Державина, 2001.
- Пальман А.Д. Синдром обструктивного апноэ во сне в терапевтической практике. – М., 1999.
- Романов А.И., Белов А.М., Каллистов Д.Ю. и др. Организация сомнологического центра. Управление, бюджет, методология. – М.: Слово, 1997.
- Chesson A.L., Berry R.B., Pack A. et al. Practice parameters for the use of portable monitoring devices in the investigation of suspected obstructive sleep apnea in adults // Sleep. – 2003. – Vol.26. – P.907‑913.
- Kushida C.A., Morgenthaler T.I., Littner M.R. et al. Practice parameters for the treatment of snoring and obstructive sleep apnea with oral appliances: an update for 2005 // Sleep. – 2006. – Vol.29. – P. 240‑243.
- Kushida C.A., Littner M.R., Hirshkowitz M. et al. Practice parameters for the use of continuous and bilevel positive airway pressure devices to treat adult patients with sleep‑related breathing disorders // Sleep. – 2006. – Vol. 29. – P.375‑380.
- Littner M., Kushida C.A., Hartse K. et al. Practice parameters for the use of laser‑assisted uvulopalatoplasty: an update for 2000 // Sleep. – 2001. – Vol.24. – P.603‑619.
- Littner M., Hirshkowitz M., Davila D. et al. Practice parameters for the use of auto‑titrating continuous positive airway pressure devices for titrating pressures and treating adult patients with obstructive sleep apnea syndrome // Sleep. – 2002. – Vol.25. – P.143‑147.
- Meoli A.L., Casey K.R., Clark R.W. et al. Hypopnea in sleep‑disordered breathing in adults // Sleep. – 2001. – Vol.24. – P.469‑470.
- Morgenthaler T.I., Kapen S., Lee‑Chiong T. et al. Practice parameters for the medical therapy of obstructive sleep apnea // Sleep. – 2006. – Vol.29. – P.1031‑1035.
- Principles and practice of sleep medicine / Kryger M. H., Roth T., Dement W. C. (Eds). – 4‑th Ed. – Philadelphia: W. B. Saunders Company, 2005.
- Respiratory disorders during sleep / McNicholas W.T. (Ed.) – Europian Respiratory Monograph 10. – UK: European respiratory society journals Ltd., 1998.
- The International classification of sleep disorders. – 2‑nd ed.: Diagnostic and coding manual. – Westchester, Illinois: American academy of sleep medicine, 2005.
- Thorpy M., Chesson A., Derderian S. et al. Practice parameters for the treatment of obstructive sleep apnea in adults: the efficacy of surgical modifications of the upper airway // Sleep. – 1996. – Vol.19. –P.152‑155.
