Синдром ожирения-гиповентиляции: современный взгляд
Рост числа людей, страдающих ожирением, является глобальной проблемой, затронувшей в последние десятилетия практически все экономически развитые страны. В числе прочего, избыточный вес может стать причиной хронической дыхательной недостаточности – так называемого синдрома ожирения-гиповентиляции, исторически также упоминающегося под названием Пиквикского синдрома (1). Под этими терминами понимается патологическое состояние, при котором у больного с ожирением (индекс массы тела > 30 кг/м2) развивается хроническая альвеолярная гиповентиляция – гиперкапническая дыхательная недостаточность (РаСО2 > 45 мм рт. ст.), которую нельзя объяснить никакими другими причинами, кроме значительного избытка веса (2, 3). При этом, хотя теоретически гипоксемия не является обязательным спутником гиперкапнии, но на практике насыщение крови кислородом у таких больных обычно также оказывается снижено. Кроме того, для пациентов с синдромом ожирения-гиповентиляции характерны нарушения дыхания во время сна. В подавляющем большинстве случаев это синдром обструктивного апноэ сна (СОАС), но у некоторых пациентов могут наблюдаться нарушения вентиляции только центрального характера (4).
Не смотря на очень частое сочетание хронической гиповентиляции и обструктивного апноэ сна у больных с избыточным весом, не следует автоматически ставить знак равенства между этими патологическими состояниями. Опубликовавшие первое клиническое наблюдение больного с дыхательной недостаточностью, хроническим легочным сердцем, дневной сонливостью и избыточным весом C.S. Burwell и соавт. (1956) посчитали, что весь имевшийся у него спектр симптомов объясняется нарушениями легочной вентиляции в результате морбидного ожирения. Однако несколько позднее именно на примере таких пациентов были описаны специфические нарушения дыхания во время сна в результате обструкции верхних дыхательных путей. Это во многом изменило взгляд врачей на суть Пиквикского синдрома и позволило C. Guilleminault и соавт. (1973) сформулировать концепцию синдрома обструктивного апноэ сна (5).
Однако, если мы обратимся к описанию полного и сонливого слуги Джо из романа
Ч. Диккенса «Посмертные записки пиквикского клуба» (6), который и послужил прообразом для авторов Пиквикского синдрома, то становится понятно, что тот страдал тяжелым СОАС, но никак не хронической дыхательной недостаточностью. Это позволило одним специалистам использовать термины «СОАС» и «синдромом Пиквика» в качестве синонимов, а другим рассматривать обструктивное апноэ сна в качестве облигатной составляющей синдрома ожирения-гиповентиляции (7). По всей видимости, оба утверждения не вполне точны. С одной стороны, встречаются пациенты с ожирением и хронической гиповентиляцией при отсутствии СОАС (8), а с другой – есть масса примеров тому, что даже крайне тяжелые формы обструктивного апноэ сна совсем не обязательно приводят к последующим нарушениям газообмена в состоянии бодрствования.
Патофизиологические механизмы, приводящие к возникновению синдрома ожирения-гиповентиляции, все еще дискутируются в литературе и, по всей видимости, представляют собой сочетание рестриктивных ограничений легочной вентиляции, нарушений респираторной механики, хронического утомления дыхательной мускулатуры и сбоя в работе центральных механизмов регуляции дыхания (9). Причем при анализе имеющихся в литературе данных складывается впечатление, что перечисленные факторы не столько предопределяют, сколько провоцируют возникновение хронической гиперкапнии у изначально склонных к этому больных, хотя однозначных доказательств наследственной предрасположенности к возникновению синдрома ожирения-гиповентиляции в настоящее время не найдено (10).
В последние годы активно обсуждается роль лептина в патогенезе синдрома ожирения-гиповентиляции. Лептин представляет собой регуляторный полипептид, продуцируемый адипоцитами, который принимает активное участие не только в регуляции жирового обмена, но и в центральных механизмах контроля дыхания, стимулируя вентиляционную чувствительность к гиперкапнии (11). Возрастание продукции лептина у пациентов с ожирением в норме приводит к увеличению легочной вентиляции, что вероятно является тем защитным механизмом, который позволяет большей части людей с избыточным весом поддерживать РаСО2 на нормальном уровне (12). В исследовании R. Shimura и соавт. (2005) и ряде других было показано, что более высокая концентрация лептина в сыворотке у пациентов с хронической гиперкапнией, напротив, не приводит у них к адекватному возрастанию вентиляции легких (13), что позволяет авторам рассматривать низкую индивидуальную чувствительность рецепторного аппарата дыхания к лептину в качестве одного из вероятных механизмов, приводящих к формированию синдрома ожирения-гиповентиляции.
Важной особенностью синдрома ожирения-гиповентиляции является значительное усугубление имеющихся дыхательных нарушений при переходе от бодрствования ко сну. Это связано как с присоединением обструкции верхних дыхательных путей у пациентов с СОАС и возрастанием нагрузки на аппарат дыхания за счет дополнительного давления абдоминального жира на диафрагму в положении лежа, так и с естественными особенностями физиологии дыхания во время сна – утратой волевого контроля, еще большим уменьшением чувствительности рецепторного аппарата к гипоксемии и гиперкапнии, а также снижением тонуса дыхательной мускулатуры, особенно во время REM-сна.
По всей видимости, определенная связь между СОАС и синдромом ожирения-гиповентиляции все же существует, но она сложна и неоднозначна. С одной стороны, ожирение является одним из основных факторов, приводящих к возникновению обструктивного апноэ сна. С другой, накоплен большой объем данных в пользу того, что СОАС способствует развитию метаболических нарушений, таких как инсулинорезистентность и сахарный диабет 2 типа. Таким образом, возникает замкнутый порочный круг, когда обструктивное апноэ сна провоцирует нарушения углеводного обмена, что, в свою очередь, способствуют прогрессированию ожирения, т.е. гиповентиляции, и одновременно утяжеляет СОАС.
Кроме того, нарушения вентиляции и неэффективные дыхательные попытки при обструкции верхних дыхательных путей способствуют более тяжелым нарушениям газообмена, возрастанию работы дыхания, утомлению дыхательной мускулатуры и дальнейшему снижению чувствительности дыхательного центра к гиперкапнии и гипоксемии.
В итоге одни исследователи считают СОАС одним из самостоятельных факторов патогенеза хронической дыхательной недостаточности у больных с ожирением (14), то время как другие не находят какой-либо зависимости между тяжестью дыхательных нарушений во время сна и выраженностью гиперкапнии в состоянии бодрствования (15). Однако, в результате мета-анализа, включавшего 15 исследований, R. Kaw и соавт. (2009) все же приходят к заключению, что тяжесть СОАС является одним из независимых предикторов последующего формирования хронической дыхательной недостаточности (16), но, опять же, не объясняют, почему у одних пациентов с ожирением и СОАС гиповентиляция в бодрствовании сохраняется, а у других – нет.
Изучая этот вопрос, мы отметили следующее: хроническая гиповентиляция у пациентов с СОАС возникает на фоне избыточного веса, но сам по себе индекс массы тела слабо предопределяет появление хронической дыхательной недостаточности, что совпадает с данными, представленными в недавно опубликованной работе A. R. Manuel и соавт. (2016) (17). При этом у пациентов с дневной гиперкапнией наблюдаются более тяжелые расстройства дыхания во время сна, а величина РаСО2 в состоянии бодрствования количественно зависит от тяжести СОАС (18).
Кроме того, развивающаяся на фоне комбинации ожирения и СОАС дыхательная недостаточность, по всей видимости, неоднородна по своей природе у разных пациентов, в пользу чего свидетельствуют значительная вариабельность в эффективности СиПАП-терапии у пациентов с синдромом ожирения-гиповентиляции (19).
Мы полагаем, что пациенты с синдромом ожирения-гиповентиляции и СОАС делятся на две подгруппы – с апноэ-зависимым и апноэ-независимым механизмами развития хронической дыхательной недостаточности. И если в первом случае коррекции СОАС бывает достаточно для нормализации показателей газообмена в бодрствовании, то во втором требуются дополнительные, более сложные терапевтические опции. При этом мы все же склонны рассматривать хроническую гиповентиляцию и обструктивное апноэ сна как два часто сочетающихся и в определенной мере ассоциированных друг с другом, но все же самостоятельных патологических состояния, развивающихся на фоне ожирения, что совпадает с актуальной позицией экспертов Американской академии медицины сна (2014).
Точных эпидемиологических данных о распространенности синдрома ожирения-гиповентиляции нами в литературе не найдено, но ориентируясь на ряд косвенных показателей, таких как встречаемость пациентов с Пиквикским синдромом среди обследуемых больных с обструктивным апноэ сна и некоторых других, можно заключить, что общее количество таких пациентов, по всей видимости, сравнительно невелико и составляет менее 1% от общей популяции. Однако если рассмотреть отдельные специфические группы, то мы увидим, что хроническая гиповентиляция развивается у трети пациентов с выраженным ожирением (20) и является одной из ведущих причин хронической гиперкапнии среди больных, госпитализированных в стационар (21), что делает синдром ожирения-гиповентиляции актуальной клинической проблемой.
Заподозрить наличие Пиквикского синдрома клинически достаточно просто (3). Перед нами больной с выраженным ожирением, предъявляющий жалобы на одышку при физических нагрузках, разбитость и сонливость в течение дня, тревожный прерывистый сон, часто сопровождаемый громким храпом, утренние головные боли, ухудшение памяти. При осмотре обращает на себя внимание цианоз, нередко – отечность ног. При этом в соответствии с особенностями патофизиологии хронической гиповентиляции, выраженное тахипноэ у такого пациента может отсутствовать, а относительно небольшое возрастание частоты дыхания не соответствовать тяжести имеющейся дыхательной недостаточности. По образному выражению C.A. Manthous и соавт. (2016) такие больные «не только не могут, но и не хотят дышать» (22).
При обследовании в общем анализе крови отмечается вторичный эритроцитоз. Исследование кислотно-щелочного состояния и газового состава крови выявляет типичную для этого состояния триаду: компенсированный респираторный ацидоз, гиперкапнию и гипоксемию. Дополнительные инструментальные методы исследования указывают на уменьшение легочных объемов, наличие легочной гипертензии, перегрузку, гипертрофию и последующую дилатацию правых камер сердца.
При кардиореспираторной полиграфии во время сна у большей части больных выявляется синдром обструктивного апноэ сна, чаще – тяжелого течения и сопровождающийся значительной гипоксемией, иногда со снижением сатурации кислорода вплоть до 50-60%. При отсутствии обструктивных нарушений дыхания во время сна регистрируется гиповентиляция. К сожалению, неинвазивные техники, позволяющие мониторировать уровень СО2 во время сна, не получили в нашей стране достаточного распространения и фактически недоступны большинству практических врачей. Поэтому для выявления гиповентиляции предлагается использовать следующий простой диагностический критерий, основывающийся на регистрации ассоциированной с ней гипоксемии – наличие эпизодов снижения сатурации кислорода <90% длительностью >5 минут, с минимальным значением SpO2 на этом отрезке ≤85% (12) и при отсутствии в это время обструктивных нарушений дыхания.
Хотя развитие и последующая декомпенсация хронического легочного сердца при отсутствии адекватной терапии является типичным осложнением синдрома ожирения-гиповентиляции, однако диагноз хронической сердечной недостаточности у таких больных не всегда бывает очевиден. Одышка, которая может усиливаться лежа, вынуждая пациента находится в положении близком к ортопноэ, в этом случае является не признаком застоя в малом круге кровообращения, наличие которого в принципе противоречит патофизиологии осложнений хронической дыхательной недостаточности, а результатом возрастающего давления абдоминального жира на диафрагму в горизонтальном положении. А причиной отеков ног могут быть часто сопутствующие избыточному весу венозная недостаточность и лимфостаз. Формальная оценка этих симптомов нередко приводит к гипердиагностике сердечной недостаточности у этой категории больных и последующему необоснованному назначению мочегонных средств. Следствием терапии петлевыми диуретиками становится метаболический алкалоз, что автоматически ведет к еще большей задержке СО2 для компенсации последнего (22).
Среди дыхательных аналептиков, потенциально эффективных при лечении пациентов с синдромом ожирения-гиповентиляции, в литературе наиболее часто упоминаются медроксипрогестерон и ацетазоламид. Показано, что медроксипрогестерон повышает чувствительность респираторной системы к гиперкапнии, приводя к возрастанию легочной вентиляции, снижению РаСО2 и возрастанию РаО2 (23), что обусловило достаточно частое его назначение пациентам с хронической гиповентиляцией вплоть до внедрения в широкую практику методов неинвазивной вентиляции легких. Однако применение этого препарата серьезно ограничивается возрастающим риском тромботических и тромбоэмболических осложнений, вероятность которых и так изначально повышена у пациентов с гиподинамией и ожирением. При наличии на сегодняшний день других, высокоэффективных и при этом безопасных способов лечения хронической гиперкапнии, применение медроксипрогестерона при синдроме ожирения-гиповентиляции представляется нам неоправданным.
Ацетазоламид – диуретик, ингибирующий карбоангидразу, вызывает метаболический ацидоз, за счет чего потенциально способен оказывать стимулирующий дыхание эффект и приводить к снижению РаСО2 (24), но на практике его терапевтическая эффективность невелика. По всей видимости, основным показанием к его назначению при альвеолярной гиповентиляции может быть наличие отечного синдрома у пациентов с декомпенсацией хронического легочного сердца. Хотя собственный диуретический эффект ацетазоламида невелик, но в комбинации с петлевыми диуретиками он может компенсировать вызываемый ими алкалоз, о негативных последствиях которого при гиперкапнии упоминалось выше.
Хотя на момент обращения к врачу больные с синдромом ожирения-гиповентиляции могут демонстрировать тяжелую гипоксемию, назначение им кислорода в качестве терапии первой линии ошибочно. К сожалению, на практике это происходит достаточно часто. Широкое распространение пульсоксиметрии, позволяющей быстро и неинвазивно оценивать сатурацию кислорода привело к тому, что практические врачи стали отказываться от более сложного технически исследования газов артериальной крови, забывая при этом, что величина SpO2 позволяет оценить кислородный статус, но оставляет за рамками содержание углекислого газа.
В норме регуляция дыхания осуществляется в зависимости от концентрации СО2, в то время как насыщение крови кислородом у здоровых людей мало влияет на параметры дыхания. При нормальном уровне РаСО2, только снижение насыщения крови кислородом менее 60 мм рт. ст. приводит к значимому увеличению вентиляции легких. Напротив, у пациентов с хронической гиперкапнией респираторный ацидоз компенсируется за счет метаболического алкалоза, рН стабильна и рецепторный аппарат системы дыхания перестает реагировать на высокий уровень РаСО2, т.е. гиперкапния перестает служить стимулом к возрастанию легочной вентиляции. В результате у больных с хронической гиповентиляцией контроль дыхания оказывается ориентирован на содержание кислорода в крови.
А раз у пациентов с хронической гиперкапнией регуляция легочной вентиляции завязана на РаО2, то применение у них ингаляционного кислорода при условии спонтанного дыхания приводит к дальнейшему уменьшению легочной вентиляции. Таким образом, назначение оксигенотерапии, ориентируясь только на коррекцию гипоксемии у таких больных, может вызвать еще большее угнетение дыхания, нарастание гиперкапнии вплоть до развития гиперкапнической комы (25) и потенциально ведет к увеличению их смертности (26).
Снижение веса является стратегической задачей для любого пациента с синдромом ожирения-гиповентиляции. Радикальное уменьшение массы тела у таких больных может нормализовать вентиляцию легких и устранить СОАС, что закономерно ведет к улучшению или даже полной нормализации показателей газообмена – как в бодрствовании, так и во время сна (27). Однако следует понимать, что любые, даже самые радикальные мероприятия, направленные на коррекцию ожирения, не обеспечат немедленного результата. Кроме того, самостоятельное похудение для таких пациентов во многих случаях оказывается непосильной задачей, а проведение хирургических вмешательств, применяемых для лечения ожирения, у таких больных потенциально затруднено из-за высокого риска осложнений, включая жизнеугрожающие (28). Это не исключает бариатрическую хирургию из арсенала средств, используемых при лечении пациентов с синдромом ожирения-гиповентиляции, но предъявляет повышенные требования к корректности отбора кандидатов, тщательности предоперационной подготовки и послеоперационного наблюдения за такими больными.
Таким образом, пациент с синдромом ожирения-гиповентиляции нередко становится для отечественных практических врачей сложно преодолимой проблемой: достаточно эффективной и безопасной медикаментозной терапии этого состояния не найдено, снижение веса может привести к положительным сдвигам только в долгосрочной перспективе, а необдуманное назначение кислорода способно вызвать еще большее угнетение дыхания. Однако мы все же имеем возможность эффективно лечить таких больных.
На сегодняшний день (рис. 1) терапией первой линии при лечении больных с синдромом ожирения-гиповентиляции является неинвазивная (масочная) вентиляция легких (29). Она полностью соответствует патофизиологической логике гиперкапнической дыхательной недостаточности, позволяя снизить нагрузку на дыхательную мускулатуру, оптимизировать механику дыхания и восстановить чувствительность дыхательного центра к СО2 (30), одновременно обеспечивая проходимость верхних дыхательных путей во время сна. Благодаря создаваемому физиологическому резерву это во многих случаях позволяет задействовать вспомогательную вентиляцию прерывисто – только во время ночного сна, когда дыхательные нарушения наиболее выражены, в то время как в бодрствовании пациент оказывается способен самостоятельно поддерживать адекватный уровень газообмена. Это не только ведет к улучшению качества жизни, но и достоверно уменьшает смертность среди этой сложной категории больных (31).
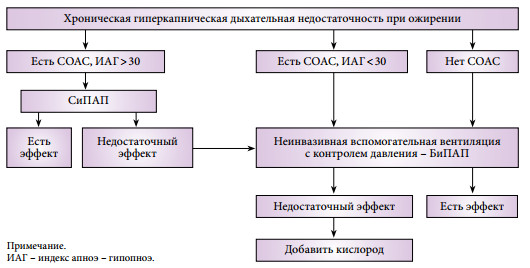
Рис. 1. Алгоритм подбора респитаторной терапии при синдроме ожирения-гиповентиляции [по L. Al Dabal и соавт. (2009) с нашими изменениями].
ИАГ – индекс апноэ-гипопноэ.
У пациентов с СОАС лечение можно начать с вентиляции в режиме СиПАП – дыхания с постоянным положительным давлением воздуха, чтобы устранить обструкцию верхних дыхательных путей во время сна. Иногда это одновременно позволяет компенсировать имеющие место хронические нарушения газообмена. Однако по нашим наблюдениям СиПАП-терапия оказывается достаточной лишь для части больных с синдромом ожирения-гиповентиляции и тяжелым СОАС. Многие пациенты с хронической дыхательной недостаточностью плохо переносят СиПАП-терапию, и эффективность лечения у них низкая, что в целом совпадает с имеющимися в литературе данными (32). Предлагаемая некоторыми авторами комбинация из СиПАП и оксигенотерапии представляется нам идеологически неверной, так как ведет к устранению гипоксемии, но не гиповентиляции как таковой. Таким образом, вентиляция в режиме СиПАП в первую очередь показана пациентам с тяжелым СОАС и умеренными нарушениями газообмена в течение дня.
Если СиПАП-терапия не привела к нормализации РаСО2 в бодрствовании и устранению гипоксемии во время сна, когда тяжесть хронической дыхательной недостаточности исходно велика или СОАС изначально отсутствует, то такому пациенту показана классическая неинвазивная вспомогательная вентиляция. Термин «вспомогательная» подразумевает, что подача аппаратных вдохов производится с учетом самостоятельных дыхательных попыток пациента и синхронизирована с ними. Наибольшее распространение для использования вне палат интенсивной терапии в нашей стране получили портативные аппараты для неинвазивной респираторной поддержки в режиме контроля по давлению – БиПАП (рис. 2). При этом давление выдоха устанавливается на уровне, позволяющем поддерживать верхние дыхательные пути в открытом состоянии, т.е. по сути соответствует величине давления СиПАП, после чего постепенно повышается давление вдоха до величины, позволяющей устранить гиповентиляцию и добиться сатурации кислорода более 90%. Разница между давлением вдоха и давлением выдоха как раз и является тем параметром, который обеспечивает необходимый эффект респираторной поддержки.
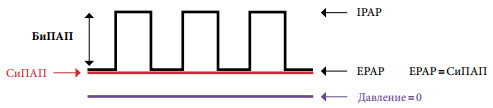
Рис. 2. Общий принцип БиПАП-терапии – два уровня положительного давления. BiPAP – БиПАП – вентиляция с двумя уровнями положительного давления; CPAP – СиПАП – вентиляция с постоянным положительным давлением; IPAP – давление на вдохе; EPAP – давление на выдохе.
У части больных на фоне начатой терапии БиПАП при условии полностью спонтанного дыхания (так называемый S-режим) могут наблюдаться периоды выраженного брадипное и центральные апноэ. По всей видимости, механизм уменьшения частоты дыхательных движений в этом случае близок к эффектам, наблюдающимся у таких пациентов при оксигенотерапии – рецепторный аппарат дыхания просто не успевает адаптироваться к новому кислородному статусу, в то время как чувствительность дыхательного центра к СО2 все еще находится на низком уровне. В этом случае показано перепрограммирование вентилятора таким образом, чтобы он мог обеспечивать контроль минимальной частоты дыхания (так называемый ST-режим). В этом случае самостоятельное дыхание пациента сохранено, но в случае его урежения менее некой заданной врачом пороговой частоты, аппарат начинает сам генерировать искусственные вдохи, навязывая больному необходимый дыхательный ритм. Наш опыт показывает, что для поддержания адекватной вентиляции легких такая пороговая частота для большей части пациентов составляет порядка 12 дыхательных циклов в минуту.
Однако следует принять во внимание, что в процессе проведении неинвазивной вентиляции происходит сложное взаимодействие между пациентом и вентилятором – механическим устройством, которое в той или иной мере навязывает больному определенные, не всегда субъективно комфортные для него параметры дыхания. Так, например, подача воздуха в маску под большим давлением не всегда хорошо переносится пациентами и нарушает их сон, что может лимитировать параметры лечения. Поэтому в случае, если целевой величины SpO2 на фоне БиПАП-терапии достигнуть не удается, то тогда на следующем этапе к лечению следует добавить кислород (33).
При острой гиперкапнической дыхательной недостаточности неинвазивная вентиляция является общепризнанным методом терапии, эффективность которого не вызывает сомнений. У пациентов с хронической гиповентиляцией респираторная поддержка, напротив, используется неоправданно редко, так как все еще рассматриваются многими клиницистами исключительно в качестве составляющей терапии критических и терминальных состояний (34). Наш опыт показывает, что у больных с хронической дыхательной недостаточностью, развившейся в исходе тяжелого ожирения, вовремя и по показаниям начатая неинвазивная вспомогательная вентиляция легких позволяет их эффективно реабилитировать и вернуть к активной жизни.
ЛИТЕРАТУРА:
- Burwell C.S., Robin E.D., Whaley R.D. et al. Extreme obesity associated with alveolar hypoventilation: A Pickwickian syndrome // Am. J. Med. – 1956. – Vol.21. – P.811-818.
- Sateia M.J. International classification of sleep disorders third edition: highlights and modifications // Chest. – 2014. – Vol.146. – P.1387-1394.
- International Classification of Sleep Disorders. – 3-rd Ed. – Westchester: American Academy of Sleep Medicine, 2014.
- Randerath W.J., Stieglitz S., Galetke W. et al. Pathophysiology of the obesity hypoventilation syndrome // Pneumologie. – 2008. – Vol. 62. – P.398-403.
- Guilleminault C., Eldriege F. L., Dement W. C. Insomnia with sleep apnea: a new syndrome // Science. – 1973. – Vol. 181. – P. 856-858.
- Диккенс Ч. Посмертные записки пиквикского клуба. – М.: Гос. изд-во художественной литературы, 1957.
- Wittels E. H., Thompson S. Obstructive sleep apnea and obesity // Otolaryngol. Clin. North Amer. – 1990. – Vol.23. – P. 751-760.
- Kessler R., Chaouat A., Schinkewitch P. et al. The obesity-hypoventilation syndrome revisited: a prospective study of 34 consecutive cases // Chest. – 2001. – Vol.120. – P.369-376.
- Shetty S., Parthasarathy S. Obesity Hypoventilation Syndrome // Curr. Pulmonol. Rep. – 2015. – Vol.4. – P.42–55.
- Jokic R., Zintel T., Sridhar G. et al. Ventilatory responses to hypercapnia and hypoxia in relatives of patients with the obesity hypoventilation syndrome // Thorax. – 2000. – Vol.55. – P.940-945.
- Инюшкина Е. М. Значение лептина в бульбарных механизмах регуляции дыхания: Дисс. ... канд. биологических наук. – Самара, 2007.
- Böing S., Randerath W. J. Chronic hypoventilation syndromes and sleep-related hypoventilation // J. Thorac. Dis. – 2015. – Vol.7. – P.1273-1285.
- Shimura R., Tatsumi K., Nakamura A. et al. Fat accumulation, leptin, and hypercapnia in obstructive sleep apnea-hypopnea syndrome // Chest. – 2005. – Vol.127. – P.543-549.
- Pankow W., Jakobeit C., Podszus T. et. al. Which factors promote chronic alveolar hypoventilation in patients with obstructive sleep apnea? // Pneumologie. – 1991. – Vol.45. – P.249-252.
- Bradley T. D., Rutherford R., Lue F. et al. Role of diffuse airway obstruction in the hypercapnia of obstructive sleep apnea // Am. Rev. Respir. Dis. – 1986. – Vol. 134. – P. 920-924.
- Kaw R., Hernandez A.V., Walker E. et al. Determinants of hypercapnia in obese patients with obstructive sleep apnea: a systematic review and metaanalysis of cohort studies // Chest. – 2009. – Vol.136. – P.787-796.
- Manuel A.R., Hart N., Stradling J.R. Correlates of obesity-related chronic ventilatory failure // BMJ Open Respir. Res. – 2016. – Vol.3. – P.1-6.
- Пальман А. Д. К вопросу о патогенезе хронической альвеолярной гиповентиляции у больных с синдромом обструктивного апноэ во сне и подходах к ее коррекции // Новые Санкт-Петербургские врачебные ведомости. – 2000. – №3. – С. 89-90.
- López-Jiménez M.J., Masa J.F., Corral J. et al. Mid- and Long-Term Efficacy of Non-Invasive Ventilation in Obesity Hypoventilation Syndrome: The Pickwick's Study // Arch. Bronconeumol. – 2016. – Vol.52. – P.158-165.
- Sin D.D., Jones R. L., Man G.C. Hypercapnic ventilatory response in patients with and without obstructive sleep apnea: do age, gender, obesity, and daytime PaCO2 matter? // Chest. – 2000. – Vol.117. – P.454-459.
- Bulbul Y., Ayik S., Ozlu T. et al. Frequency and predictors of obesity hypoventilation in hospitalized patients at a tertiary health care institution // Ann. Thorac. Med. – 2014. –
Vol. 9. – P.87–91. - Manthous C. A., Mokhlesi B. Avoiding management errors in patients with obesity hypoventilation syndrome // Ann. Am. Thorac. Soc. – 2016. – Vol.13. – P.109-114.
- Sutton F.D., Zwillich C.W., Creagh C.E. et al. Progesterone for outpatient treatment of Pickwickian syndrome // Ann. Intern. Med. – 1975. – Vol.83. – P.476-479.
- Swenson E.R. Carbonic anhydrase inhibitors and ventilation: A complex interplay of stimulation and suppression // Eur. Respir. J. – 1998. – Vol.12. – P.1242–1247.
- Hollier C.A., Harmer A.R., Maxwell L.J. et al. Moderate concentrations of supplemental oxygen worsen hypercapnia in obesity hypoventilation syndrome: a randomised crosso-ver study // Thorax. – 2014. – Vol.69. – P.346-353.
- Fitzgerald D.A., Follett J., Van Asperen P.P. The effect of supplemental oxygen on hypercapnia in subjects with obesity-associated hypoventilation: a randomized, crossover, clinical study // Chest. – 2011. – Vol.139. – P.1018-1024.
- Marti-Valeri C., Sabate A., Masdevall C. et al. Improvement of associated respiratory problems in morbidly obese patients after open Roux-en-Y gastric bypass // Obestet. Surg. – 2007. – Vol.17. – P.1102-1110.
- Flum D.R., Belle S.H., King W.C. et al. Perioperative safety in the longitudinal assessment of bariatric surgery // N. Engl. J. Med. – 2009. – Vol.361. – P.445-454.
- Al Dabal L., BaHammam A.S. Obesity hypoventilation syndrome // Ann. Thorac. Med. – 2009. – Vol.4. – P. 41-49.
- Elliott M., Nava S., Schonhofer B. Non-invasive Ventilation and Weaning: Principles and Practice. – Edward Arnold Publishers Ltd., 2010. – P.228-235.
- Priou P., Hamel J.F., Person C. et al. Long-term outcome of noninvasive positive pressure ventilation for obesity hypoventilation syndrome // Chest. – 2010. – Vol.138. – P.84–90.
- Masa J.F., Corral J., Alonso M.L. et al. Efficacy of Different Treatment Alternatives for Obesity Hypoventilation Syndrome: Pickwick Study // Am. J. Respir. Crit. Care Med. – 2015. – Vol.192. – P.86-95.
- Shetty S., Parthasarathy S. Obesity hypoventilation syndrome // Curr. Pulmonol. Rep. – 2015. – Vol.4. – P.42-55.
- Батурова В.Ю., Малявин А.Г., Пальман А.Д. Домашняя неинвазивная вентиляция легких у больных с хронической гиперкапнической дыхательной недостаточностью // Клиническая геронтология. – 2015. – №11-12. – С. 33-38.
