Желудочковые нарушения ритма сердца у пациента с синдромом обструктивного апноэ сна и их эффективное немедикаментозное лечение
А. Д. Пальман, А. С. Аксельрод
Синдром обструктивного апноэ сна (СОАС) является широко распространенным и весьма серьезным своими последствиями патологическим состоянием, напрямую связанным со сном. По данным исследований последних лет в экономически развитых странах от этого заболевания страдает около 10% взрослого населения [1], что значительно повышает у них риск сердечно-сосудистой заболеваемости и смертности [2].
О наличии различных нарушений сердечного ритма у пациентов с обструктивными нарушениями дыхания во время сна известно давно [3]. Однако если взаимосвязь между СОАС и фибрилляцией предсердий считается доказанной [4, 5], что нашло свое отражение в клинических рекомендациях [6], наличие зависимости между апноэ сна и желудочковыми нарушениями ритма считается не столь очевидной и представляет предмет для дискуссий [7].
Приводим собственное клиническое наблюдение.
ОПИСАНИЕ СЛУЧАЯ
Мужчина 51 года, офисный работник, был направлен на консультацию в сомнологический кабинет университетской клинической больницы №1 в сентябре 2020 г. в связи с выявленными у него преимущественно ночными нарушениями сердечного ритма.
На момент обращения предъявлял жалобы на одышку при физической нагрузке умеренной интенсивности (быстрая ходьба), а также при целенаправленном расспросе отмечал наличие у него громкого храпа во время сна и дневной сонливости, которая проявлялась неконтролируемыми засыпаниями при просмотре телепередач или при езде в транспорте в качестве пассажира.
Из анамнеза известно, что пациент длительно страдает гипертонической болезнью 2 стадии, 3 степени повышения артериального давления (АД), с очень высоким риском сердечно-сосудистых осложнений, контролируемой на фоне приема гипотензивных препаратов и сахарным диабетом 2 типа. Повышение АД отмечает более 10 лет с максимальными его подъемами до 190/110 мм рт. ст. В последние годы тщательно следит за цифрами АД, на фоне приема периндоприла 10 мг, индапамида 2.5 мг утром и амлодипина 5 мг вечером АД стабилизировано в пределах 135-145/85-90 мм рт. ст., с редкими подъемами максимально до 155/100 мм рт. ст., обычно утром сразу после пробуждения, что не требовало назначения дополнительной терапии «по требованию». Сахарный диабет 2 типа диагностирован 7 лет назад. Получает терапию метформином пролонгированного действия 1000 мг вечером и алоглиптином 25 мг утром, в соответствии с рекомендациями наблюдающего его эндокринолога контролирует уровень гликемии натощак и гликированного гемоглобина.
Храпит около двадцати лет, в последние 3 года на фоне значительной (более 20 кг) прибавки в весе храп усилился, пациент стал отмечать одышку при ходьбе, появились дневная сонливость и разбитость независимо от длительности предшествовавшего ночного сна.
Курение или злоупотребление алкоголем отрицает, профессиональные вредности отсутствуют.
При осмотре состояние удовлетворительное. Наблюдается значительный избыток веса: при росте 176 см пациент весит 125 кг, индекс массы тела 40.3 кг/м2, что соответствует ожирению 3 степени. Аускультативно над легкими хрипы не выслушиваются. Частота дыхания 18 в мин. Сатурация крови кислородом, измеренная с помощью пульсоксиметра, в покое 98%, после быстрой ходьбы по коридору снижается до 96% (при норме более 95%), но быстро восстанавливается до исходного уровня в покое. Тоны сердца в целом ритмичны, при аускультации отмечена редкая экстрасистолия. ЧСС 80 в мин., АД 140/85 мм рт. ст. Печень не пальпируется. Симптом поколачивания отрицательный. Голени пастозны.
Незадолго до обращения к сомнологу пациент прошел плановое амбулаторное обследование.
Согласно представленной медицинской документации в общем анализе крови без особенностей. В биохимическом анализе крови значимые метаболические или электролитные нарушения не выявлялись, за исключением тенденции к повышению уровня общего холестерина: глюкоза 5.8ммоль/л (целевой уровень <6.0ммоль/л), калий 4.1 ммоль/л(норма 3.5–5.0ммоль/л), креатинин86мкмоль/л (норма 74–110 мкмоль/л), общий холестерин 6.3ммоль/л (целевой уровень <4.5 ммоль/л), расширенное исследование липидного спектра крови не проводилось. Уровень HbA1C 6.4% (целевой уровень <7.0%).
На электрокардиограмме (ЭКГ) покоя зарегистрирован синусовый ритм с ЧСС 82 в минуту, отклонение ЭОС влево, нарушения проводимости не выявлены; имеются вольтажные признаки гипертрофии левого желудочка и одиночная желудочковая экстрасистола.
По результатам эхокардиографического исследования полости сердца не расширены, имеются признаки умеренной гипертрофии левого желудочка. Сократительная функция миокарда левого желудочка в пределах нормы, фракция выброса 61%. Зон гипокинезии не выявлено, клапанный аппарат интактен. Наблюдаются признаки умеренной легочной гипертензии.
При суточном мониторировании ЭКГ зарегистрирован синусовый ритм с ЧСС 41-126 в мин., средняя ЧСС 79 в мин. Выявлена частая одиночная мономорфная желудочковая экстрасистолия (ЖЭ), в том числе по типу бигеминии, преимущественно во время сна: всего 1350 экстрасистол днем и 3474 – ночью. Также во время сна зарегистрированы два коротких (из 8 и 12 циклов) пароксизма регулярного ритма с широкими комплексами с ЧСС 65 в минуту (вероятнее всего, ускоренный идиовентрикулярный ритм). Сегмент ST без значимой динамики.
Пациенту было проведено ночное кардиореспираторное мониторирование с синхронной регистрацией назального воздушного потока, храпа, дыхательных усилий груди и живота, сатурации крови кислородом и одного канала ЭКГ. По результатам исследования индекс апноэ-гипопноэ составил 57 респираторных событий в час (норма <5 в час) с максимальной длительностью обструктивного апноэ до 74 сек. Минимальная сатурация кислородом во время сна 73% при средней сатурации за ночь 91%. На ЭКГ зарегистрирована частая одиночная мономорфная ЖЭ, в том числе по типу бигемении, и один короткий (7 циклов) пароксизм регулярного ритма с широкими комплексами с ЧСС 60 в минуту (вероятнее всего, ускоренный идиовентрикулярный ритм).
Исходя из результатов кардиореспираторного исследования, большая часть экстрасистол и пароксизм ускоренного идиовентрикулярного ритма были ассоциированы с длительными апноэ, приводящими к тяжелой десатурации (рисунки 1, 2 и 3). Сделано заключение о наличии у пациента СОАС тяжелой степени, тяжелой ночной гипоксемии и нарушений сердечного ритма, ассоциированных с обструктивными апноэ.
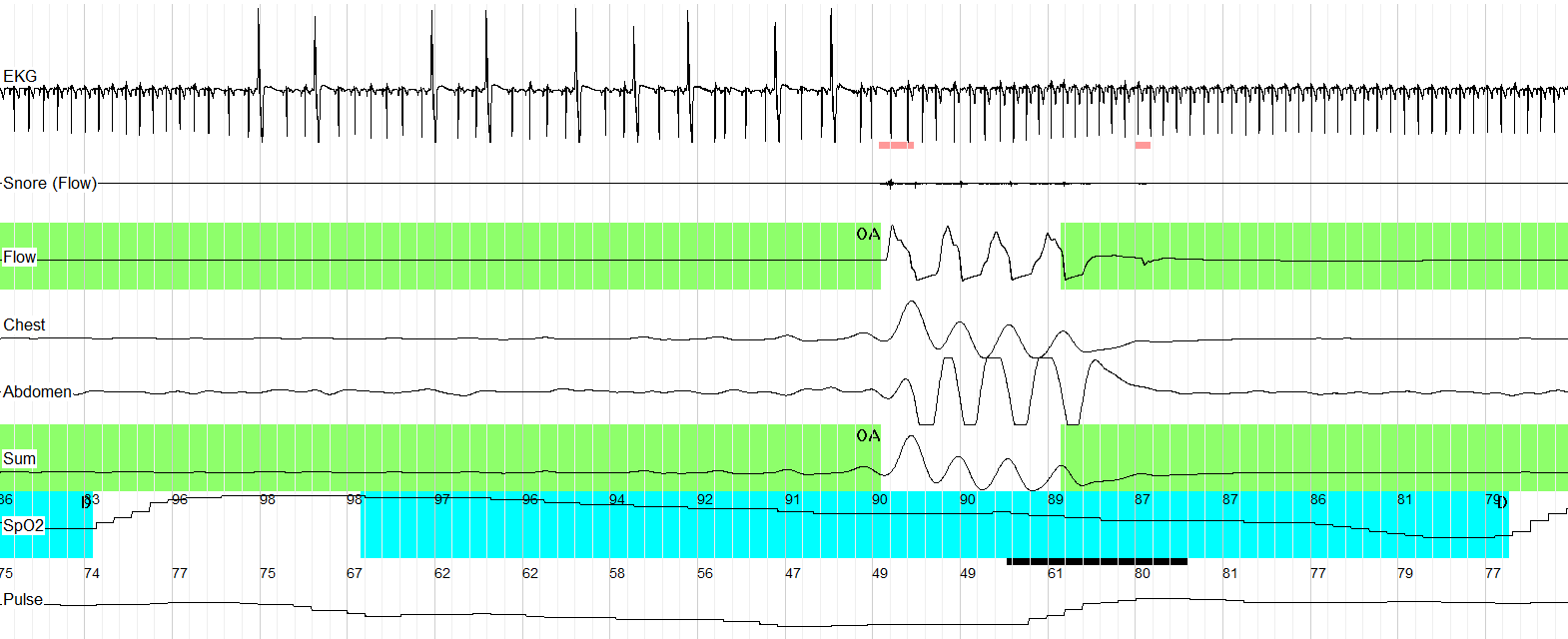
Рис. 1. Кардиреспираторное мониторирование (фрагмент записи 60 сек.). Частая ЖЭ в конечной части обструктивного апноэ длительностью 57 сек.
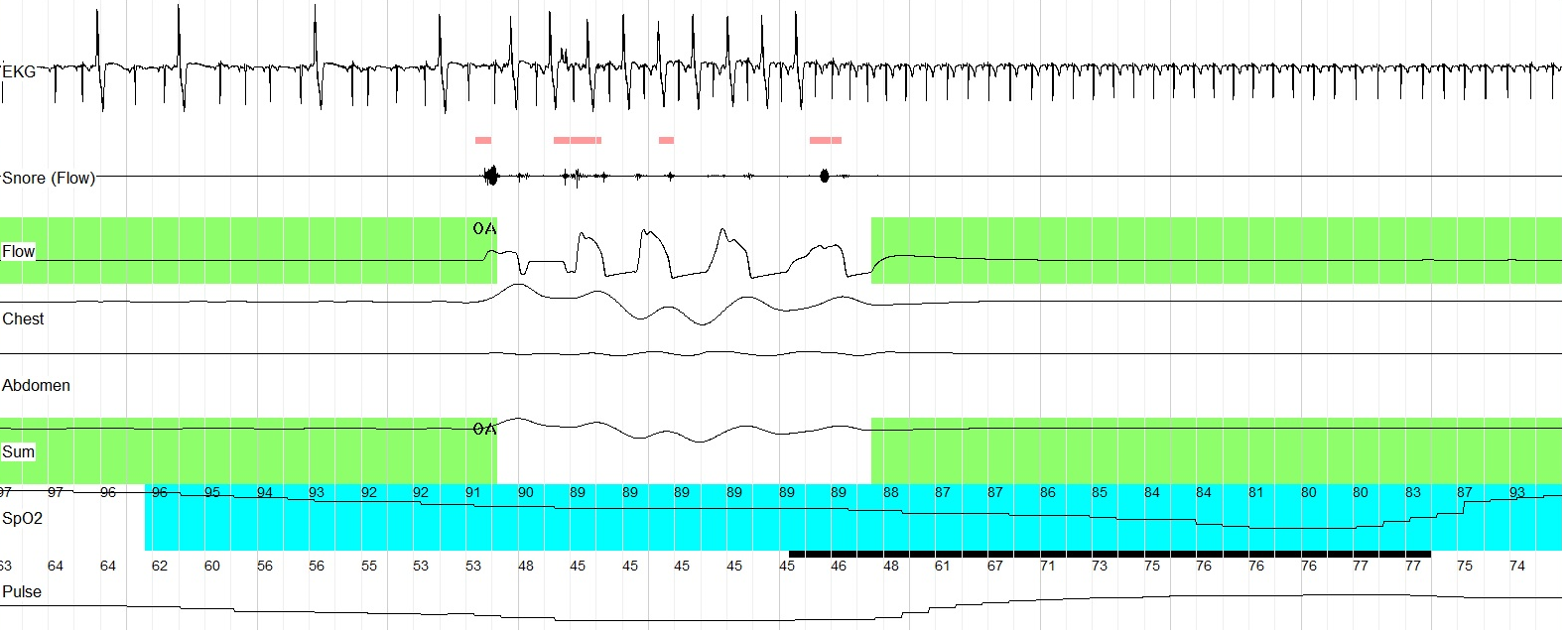
Рис. 2. Кардиреспираторное мониторирование (фрагмент записи 60 сек.). На фоне восстановления дыхания после обструктивного апноэ, длившегося 63 сек., регистрируется частая ЖЭ (бигеминия).
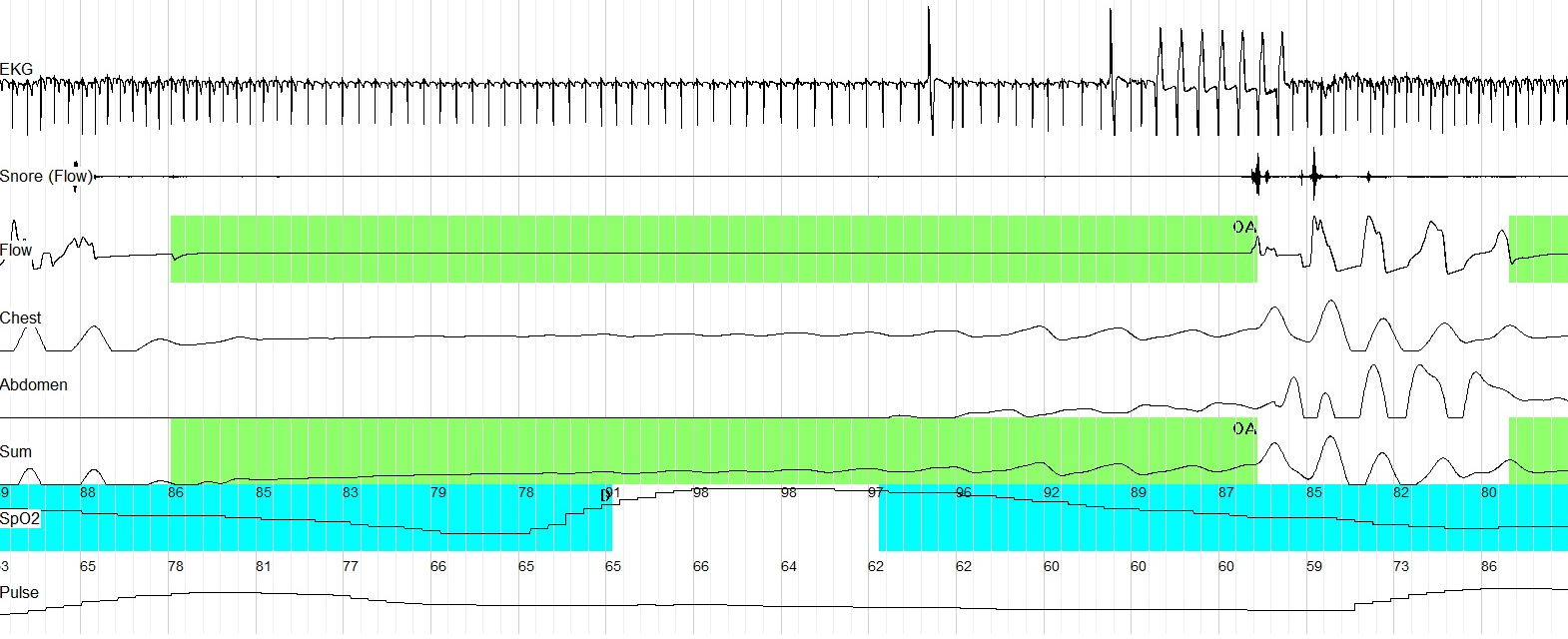
Рис. 3. Кардиреспираторное мониторирование (фрагмент записи 90 сек.).Короткий (7 циклов) пароксизм регулярного ритма с широкими комплексами (ускоренный идиовен-трикулярный ритм) в конечной части обструктивного апноэ, длившегося 60 сек.
Такая тяжесть нарушений дыхания во время сна является абсолютным показанием к СИПАП-терапии. Было начато лечение с использованием аппарата Авто-СИПАП с интегрируемым пульсоксиметрическим модулем, в режиме автоматического титрования давления в диапазоне 4–16 см водн. столба. Контроль эффективности терапии осуществлялся посредством штатного программного обеспечения прибора. При оценке через 7 дней после начала лечения констатирована полная компенсация дыхательных нарушений во время сна: остаточный индекс апноэ-гипопноэ составил 4 в час, средняя сатурация кислородом в это время не опускалась ниже 90% и в среднем составила 94%. Сам пациент при этом отметил исчезновение дневной сонливости.
При контрольном холтеровском мониторировании на фоне продолжающейся СИПАП-терапии количество одиночных желудочковых экстрасистол во время сна уменьшилось практически в два раза, сравнявшись с наблюдающимися в период бодрствования–всего 1275 днем и 1476 ночью. Эпизодов ускоренного идиовентрикулряного ритма не выявлено.
Больному рекомендовано продолжение СИПАП-терапии во время ночного сна на регулярной основе, а также дообследование для исключения у него ИБС и решения вопроса о назначении адекватной гиполипидемической терапии.
ОБСУЖДЕНИЕ
Желудочковые аритмии во время сна, такие как экстрасистолия и пароксизмальные желудочковые нарушения сердечного ритма, являются нередкой находкой у пациентов с СОАС [3, 8, 9]. Считается, что основные патофизиологические механизмы, потенциально ответственные за их возникновение, включают гипоксемию, колебания внутригрудного давления, ведущие к возрастанию венозного возврата к сердцу, и симпатическую активацию на фоне следующего за апноэ микропробуждения [10].
Вероятность возникновения нарушений сердечного ритма возрастает с увеличением индекса апноэ-гипопноэ и тяжести развивающейся ночной гипоксемии [11], причем тяжелая гипоксемия является наиболее значимым предиктором возникновения желудочковых аритмий во время сна у пациентов с СОАС [12]. При этом желудочковые нарушения ритма чаще возникают на фоне эпизодов апноэ, а не следующей за ними фазы микропробуждения и компенсаторной гипервентиляции [3,13]. Таким образом, вероятно, что за желудочковый аритмогенез у пациентов с СОАС в большей степени ответственны гипоксемия и, возможно, колебания внутригрудного давления, а последующая симпатическая активация играет меньшую роль. Кроме того, нельзя исключить дополнительный вклад коморбидной патологии, такой как ИБС или ХСН [7,14]. Это предположение представляется вполне логичным с точки зрения очевидного вклада гиперсимпатикотонии, патогенетически имеющейся при обоих этих состояниях, в электрическую нестабильность миокарда желудочков у пациентов с ИБС, ХСН и СОАС.
Возможно, что включение в исследования пациентов как с тяжелым, так и сравнительно легким СОАС или без учета сопутствующих сердечно-сосудистых заболеваний, ответственны за то, что некоторые авторы не видят достоверной связи межу обструктивным апноэ сна и желудочковыми аритмиями [15]. Если же обследуемая популяция включает только пациентов с тяжелым СОАС, то частая желудочковая экстрасистолия и неустойчивая желудочковая тахикардия в ночные часы возникают у них в 2-3 раза чаще, чем в идентичной группе сравнения, но с нормальными параметрами дыхания во время сна [16].
На сегодняшний день приоритетным методом лечения пациентов с среднетяжелым и тяжелым СОАС является неинвазивная вентиляция с постоянным положительным давлением воздуха во время сна – так называемая СИПАП-терапия [17]. В ряде работ показано, что терапия положительным давлением позволяет предотвращать желудочковые нарушения ритма во время сна у пациентов с СОАС [18, 19]. Напротив, некоторые исследователи, признавая эффективность СИПАП-терапии в целом, не обнаруживают пользы такого лечения применительно к ночным желудочковым аритмиям [20, 21]. Однако следует учитывать различную продолжительность СИПАП-терапии, соблюдение или несоблюдение пациентами оптимального режима лечения, исходно разную тяжесть СОАС и наличие фоновой сердечно-сосудистой патологии, что в итоге может объяснить кажущуюся противоречивость полученных авторами этих исследований результатов [14].
Наблюдавшийся нами пациент является наглядной иллюстрацией ко всему сказанному выше. У него крайне тяжелый СОАС, при котором обструктивные респираторные события становятся причиной желудочковых нарушений сердечного ритма во время сна. При этом частая желудочковая экстрасистолии по типу бигеминии и пароксизм ускоренного идиовеентрикулярного ритма большей частью возникают в терминальной части эпизодов апноэ большой длительности, когда гипоксемия особенно велика и реже – на фоне восстановления нормального дыхания. Однако мы неоднократно видели пациентов с СОАС сходной тяжести, но без каких-либо клинически значимых нарушений сердечного ритма. Здесь необходимо вернуться к вопросу о роли сопутствующей патологии. Пациент страдает АГ, сахарным диабетом и ожирением. Кроме того, у него наблюдается тенденция к повышению уровня холестерина. Таким образом, его миокард оказывается в той или иной степени скомпрометирован, а отсутствие ишемических изменений при холтеровском мониторировании не позволяет полностью исключить наличие значимого коронарного атеросклероза. Тот факт, что на фоне СИПАП-терапии и нормализации дыхания во время сна количество желудочковых экстрасистол в дневные часы осталось прежним, а ночью хоть и уменьшилось существенно, но осталось достаточно большим, лишний раз указывает на проаритмическую роль имеющейся у пациента множественной коморбидной патологии. Именно комбинация тяжелого СОАС с АГ, сахарным диабетом и ожирением представляется нам ответственной за последующие значительные желудочковые нарушения сердечного ритма во время сна.
ЗАКЛЮЧЕНИЕ
У некоторых пациентов с СОАС нарушения дыхания во время сна могут приводить к клинически значимым желудочковым аритмиям. В первую очередь это будут больные с сочетанием тяжелого СОАС и сердечно-сосудистой патологии. У таких пациентов адекватная тяжести болезни СИПАП-терапия не только улучшает качество жизни, но и оказывает опосредованный антиаритмический эффект.
Таким образом, у пациентов с факторами риска СОАС (храп, ожирение, дневная сонливость) и отягощенным сердечно-сосудистым анамнезом необходимо проводить двойной превентивный скрининг, направленный как на диагностикуапноэ сна, так и возможных сопутствующих ему нарушений сердечного ритма, в том числе и желудочковых. При выявлении преимущественно ночных нарушений ритма сердца у пациента с тяжелым СОАС приоритетным является нормализация дыхания во время сна. Только после этого можно рассмотреть вопрос о необходимости медикаментозной антиаритмической терапии.
ЛИТЕРАТУРА
- Peppard P.E., Young T., Barnet J.H., et al. Increased prevalence of sleep-disordered breathing in adults. Am. J. Epidemiol. 2013. 177(9):1006-1014. doi: 10.1093/aje/kws342
- Marin J.M., Carrizo S.J., Vicente E., Agusti A.G. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet. 2005. 365(9464):1046-1053. doi: 10.1016/S0140-6736(05)71141-7
- Guilleminault C., Connolly S.J., Winkle R.A. Cardiac arrhythmia and conduction disturbances during sleep in 400 patients with sleep apnea syndrome. Am. J. Cardiol. 1983. 52(5):490-494. doi: 10.1016/0002-9149(83)90013-9
- Vizzardi E., Sciatti E., Bonadei I., et al. Obstructive sleep apnoea-hypopnoea and arrhythmias: new updates. J. Cardiovasc. Med. 2017. 18(7):490-500. doi: 10.2459/JCM.0000000000000043
- Певзнер А.В., Байрамбеков Э.Ш., Литвин А.Ю. и соавт. Результаты применения терапии с созданием постоянного положительного давления воздуха в верхних дыхательных путях при лечении больных с фибрилляцией предсердий и синдромом обструктивного апноэ во время сна. Российский кардиологический журнал. 2017. (7):111-116. https://doi.org/10.15829/1560-4071-2017-7-111-116
- Kirchhof P, Benussi S, Kotecha D, et al. ESC Scientific Document Group. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur. Heart J. 2016. 37(38):2893-2962. doi: 10.1093/eurheartj/ehw210.
- Raghuram A., Clay R., Kumbam A., et al. A systematic review of the association between obstructive sleep apnea and ventricular arrhythmias. J. Clin. Sleep Med. 2014.10(10):1155-60. doi: 10.5664/jcsm.4126
- Almeneessier AS, Alasousi N, Sharif MM, et al. Prevalence and Predictors of Arrhythmia in Patients with Obstructive Sleep Apnea. Sleep Sci. 2017. 10(4):142-146. doi: 10.5935/1984-0063.20170025
- Царева В.М., Новицкий Н.И. Взаимосвязь желудочковых аритмий с нарушениями дыхания во сне у женщин с ИБС в постменопаузе. Забайкальский медицинский вестник. 2018. (3): 78-86.
- May AM, Van Wagoner DR, Mehra R. OSA and Cardiac Arrhythmogenesis: Mechanistic Insights. Chest. 2017. 151(1):225-241. doi: 10.1016/j.chest.2016.09.014
- Selim BJ, Koo BB, Qin L, et al. The Association between Nocturnal Cardiac Arrhythmias and Sleep-Disordered Breathing: The DREAM Study. J. Clin. Sleep Med. 2016. 12(6):829-837. doi: 10.5664/jcsm.5880
- Shepard JW Jr, Garrison MW, Grither DA, Dolan GF. Relationship of ventricular ectopy to oxyhemoglobin desaturation in patients with obstructive sleep apnea. Chest. 1985. 88(3):335-40. doi: 10.1378/chest.88.3.335
- Ryan CM, Juvet S, Leung R, Bradley TD. Timing of nocturnal ventricular ectopy in heart failure patients with sleep apnea. Chest. 2008. 133(4):934-40. doi: 10.1378/chest.07-2595
- Marinheiro R, Parreira L, Amador P, et al. Ventricular Arrhythmias in Patients with Obstructive Sleep Apnea. CurrCardiol Rev. 2019;15(1):64-74. doi: 10.2174/1573403X14666181012153252
- Roche F, Xuong AN, Court-Fortune I, et al. Relationship among the severity of sleep apnea syndrome, cardiac arrhythmias, and autonomic imbalance. Pacing ClinElectrophysiol. 2003. 26(3):669-77. doi: 10.1046/j.1460-9592.2003.00116.x
- Mehra R, Benjamin EJ, Shahar E, et al. Sleep Heart Health Study. Association of nocturnal arrhythmias with sleep-disordered breathing: The Sleep Heart Health Study. Am. J. Respir. Crit. Care Med. 2006. 173(8):910-916. doi: 10.1164/rccm.200509-1442OC
- Patil SP, Ayappa IA, Caples SM, et al. Treatment of Adult Obstructive Sleep Apnea with Positive Airway Pressure: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med. 2019. 15(2):335-343. doi: 10.5664/jcsm.7640
- Harbison J, O'Reilly P, McNicholas WT. Cardiac rhythm disturbances in the obstructive sleep apnea syndrome: effects of nasal continuous positive airway pressure therapy. Chest. 2000.118(3):591-595. doi: 10.1378/chest.118.3.591
- Seyis S, Usalan AK, Rencuzogullari I, et al. The Effects of Continuous Positive Airway Pressure on Premature Ventricular Contractions and Ventricular Wall Stress in Patients with Heart Failure and Sleep Apnea. Can Respir J. 2018. 2018:2027061. doi: 10.1155/2018/2027061
- Craig S, Pepperell JC, Kohler M, et al. Continuous positive airway pressure treatment for obstructive sleep apnoea reduces resting heart rate but does not affect dysrhythmias: a randomised controlled trial. J Sleep Res. 2009 Sep;18(3):329-36. doi: 10.1111/j.1365-2869.2008.00726.x
- Roche F, Barthélémy JC, Garet M, et al. Continuous positive airway pressure treatment improves the QT rate dependence adaptation of obstructive sleep apnea patients. Pacing ClinElectrophysiol. 2005. (8):819-825. doi: 10.1111/j.1540-8159.2005.00188.x
