Сомнологический кабинет
УНИВЕРСИТЕТСКОЙ КЛИНИЧЕСКОЙ БОЛЬНИЦЫ № 1ПЕРВОГО МОСКОВСКОГО ГОСУДАРСТВЕННОГО МЕДИЦИНСКОГО УНИВЕРСИТЕТА им. И. М. Сеченова
+7 (495) 178-01-04
+7 (915) 432-96-50
Заказать звонокТолько Москва и Моск. область
Синдром обструктивного апноэ сна и нарушения сердечного ритма
Синдром обструктивого апноэ сна (СОАС) относится к числу широко распространенных патологических состояний, в настоящее время в экономически развитых странах это заболевание наблюдается приблизительно у 8-10% населения. При этом в некоторых специфических популяциях СОАС встречается еще чаще. Так, по нашим данным, до трети пациентов кардиологического профиля страдают обструктивным апноэ сна [1], что в целом совпадает с результатами зарубежных эпидемиологических исследований. При этом, на сегодняшний день можно считать доказанной наличие взаимосвязи СОАС с сердечно-сосудистой заболеваемостью и смертностью. В частности, хорошо известно, что для пациентов с обструктивным апноэ характерны нарушения сердечного ритма [2]. Так, в недавно опубликованной работе Cintra F.D. et al (2014) в очередной раз продемонстрирована прямая зависимость между тяжестью сонного апноэ и представленностью аритмий. Кроме того, авторами показано, что у пациентов с выраженными нарушениями дыхания во время сна сердечные аритмии наблюдаются в 92% случаев [3]. И хотя не все упоминающиеся в этом исследовании нарушения ритма сердца с точки зрения современных практических рекомендаций являются клинически значимыми и требуют специального вмешательства, данные этого исследования хорошо иллюстрируют актуальность обсуждаемой нами проблемы.
Вопрос о характере, физиологии и клинической значимости аритмий, возникающих на фоне СОАС, продолжает активно дискутироваться в медицинской литературе. Определенная сложность при трактовке обнаруживаемых у пациентов с сонным апноэ нарушений сердечного ритма обусловлена тем, что в значительном числе случаев такие больные имеют многие другие факторы риска и сочетанную сердечно-сосудистую патологию, так что роль нарушений дыхания во время сна не всегда представляется однозначной.
Патофизиологические механизмы, лежащие в основе нарушений сердечного ритма при апноэ сна, по всей видимости, комплексны и многообразны [4]. Основными факторами аритмогенеза у пациентов с СОАС называют ассоциированные с апноэ расстройствами газообмена, нарушения в структуре сна и колебания внутригрудного давления, оказывающие как прямое – острое, так и опосредованное – хроническое – проаритмическое действие (рисунок 1).
Сопровождающая респираторные паузы гипоксемия, являющаяся характерным признаком СОАС, синхронизирована с эпизодами апноэ и вследствие этого носит циклический характер. Однако у части пациентов короткие периоды между дыхательными паузами могут оказаться недостаточными для того, чтобы восстановить насыщение кислородом до нормального уровня, что может стать причиной тяжелой дыхательной недостаточности во время сна. Нарушения газообмена вызывают вазоконстрикцию, стимуляцию симпатического отдела вегетативной нервной системы с гиперпродукцией катехоламинов [5], а также активацию процессов перекисного окисления [6], что оказывает комплексное повреждающее действие на сердечную мышцу.
Нами были ретроспективно проанализированы истории болезни 20 пациентов, госпитализированных в кардиологический стационар по поводу ишемической болезни сердца и у которых при обследовании был выявлен СОАС. У 7 больных при холтеровском мониторировании отмечено преобладание нарушений сердечного ритма (предсердная и желудочковая эксрасистолия, короткие пробежки суправентрикулярной и желудочковой тахикардии) во время ночного сна по сравнению с периодом бодрствования. Пациенты с преимущественно ночными аритмиями не отличалась значимо от остальных больных по тяжести дыхательных нарушений, определяемых на основании индекса апноэ-гипопноэ, но демонстрировали достоверно более низкие показатели насыщения крови кислородом во время сна. Это позволило нам сделать заключение, что зачастую не столько абсолютное число респираторных пауз, сколько тяжесть вызываемой ими гипоксемии является определяющей для возникновения нарушений сердечного ритма у больных с СОАС [7].
Эпизоды обструктивного апноэ обычно завершаются реакцией активации – кратковременным изменением в состоянии сна, проявляющимся транзиторным возрастанием мозговой активности, но без полного поведенческого пробуждения. Такие микропробуждения играют роль защитного механизма, позволяющего восстановить нормальную проходимость верхних дыхательных путей. Однако многократные мозговые активации ведут к грубым нарушениям структуры сна, что с физиологической точки зрения представляет собой хронический стресс и также сопровождаются вегетативной симпатической активацией [8].
Возрастающие на фоне обструкции верхних дыхательных путей неэффективные дыхательные усилия ведут к значительному снижению давления в грудной клетке. В результате, внутригрудные вены и камеры сердца расширяются за счет механического растяжения их стенок, что значительно увеличивает возврат венозной крови к сердцу и возрастание объемной нагрузки – так называемая центральная псевдогиперволемия. Повторяясь регулярно, эти эффекты оказываются в ряду основных причин, запускающих процессы ремоделирования миокарда у пациентов с СОАС [9]. Кроме того, наряду с изменениями гемодинамики, колебания внутригрудного давления еще больше усугубляют наблюдающееся при апноэ сна состояние симпатической активации [8].
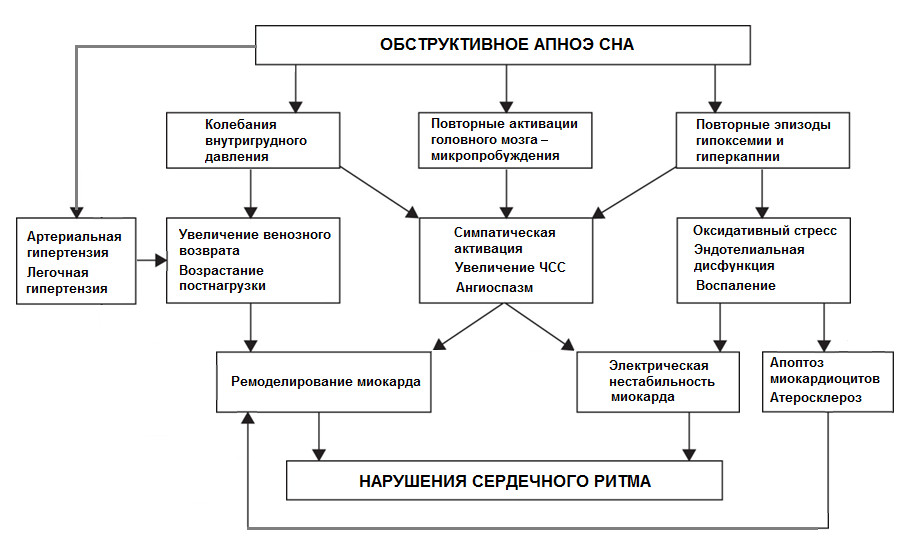
Рисунок 1. Вероятные патогенетические механизмы нарушений сердечного ритма у пациентов с СОАС [по V. A. Rossi et al. (2013), c изменениями].
В целом ряде исследований показано, что для пациентов с СОАС характерны разнообразные нарушения ритма сердца – синусовая брадикардия вплоть до остановки синусового узла, предсердная и желудочковая экстрасистолия, суправентрикулярные тахиаритмии и эпизоды неустойчивой желудочковой тахикардии. При этом вероятность ночных аритмий у пациентов с сонным апноэ до 4 раз выше по сравнению с контролем [10]. Таким образом, возникающие преимущественно во время сна нарушения сердечного ритма справедливо рассматриваются в качестве одного из значимых предикторов и клинических маркеров СОАС.
У большой части пациентов с СОАС эпизоды апноэ сопровождает синусовая аритмия, характеризующаяся прогрессирующей брадикардией, в отдельных наиболее тяжелых случаях вплоть до асистолии, которая резко сменяется тахикардией после возобновления легочной вентиляции (рисунок 2). Причем степень урежения частоты сердечных сокращений коррелирует с длительностью эпизода апноэ и тяжестью развивающейся гипоксемии. Это приводит к существенному увеличению вариабельности частоты сердечных сокращений во время сна, в то время как кривая частоты сердечных сокращений приобретает своеобразную синусоидоподобную форму.
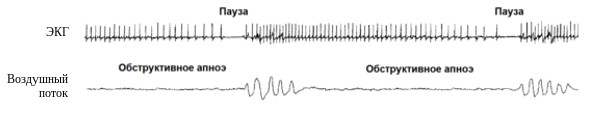
Рисунок 2. Сопровождающая эпизоды обструктивного апноэ синусовая аритмия. На фоне исчезновение респираторного потока наблюдается прогрессирующая брадикардия, которая сменяется компенсаторной тахикардией после восстановления вентиляции легких.
Эта аритмия не является отражением какого-либо заболевания сердца, никогда не возникает в состоянии бодрствования, как правило, не сопровождается субъективной симптоматикой и полностью исчезает после устранения СОАС. Если на фоне эффективного лечения обструктивного апноэ сна ночная брадиаритмия сохраняется, то это указывает на отличную, не связанную с СОАС, природу наблюдающихся у такого пациента нарушений сердечного ритма.
Согласно C. Zwillich et al. (1982), причиной ассоциированной с эпизодами обструктивного апноэ брадиаритмии является так называемый «рефлекс ныряльщика», в соответствии с которым гипоксия вызывает брадикардию, а не тахикардию при отсутствии легочной вентиляции [11]. Показано, что длительная задержка дыхания сопровождается прогрессирующим уменьшением частоты сердечных сокращений и вазоконстрикцией во всех органах, за исключением головного мозга и сердца. Такая реакция позволяет уменьшить потребление кислорода и, таким образом, перераспределить системный кровоток, чтобы обеспечить преимущественное кровоснабжение и оксигенацию наиболее важных органов. При этом отмечается необычное сочетание брадикардии, вызванной увеличенной активностью парасимпатических нервов сердца, и периферической вазоконстрикции, обусловленной усиленной симпатической активностью, что представляет редкое исключение из общего правила реципрокной активации симпатического и парасимпатического отделов нервной системы [12]. В дополнение к этому, обусловленные обструкцией верхних дыхательных путей неэффективные дыхательные попытки сами по себе могут приводить к рефлекторному урежению частоты сердечных сокращений [13].
Возобновление вентиляции легких на пике резвившейся к этому моменту гипоксемии приводит к возникновению компенсаторной тахикардии. Кроме того, сопровождающая восстановление дыхания мозговая активация вызывает еще большее повышение симпатического тонуса, что вносит дополнительный вклад в генез возникающего после окончания апноэ резкого возрастания частоты сердечных сокращений.
Вопрос о клинической значимости связанной с СОАС синусовой аритмии до настоящего времени дискутируется. Несмотря на исходно доброкачественный ее характер, выраженная брадикардия сопровождается существенным уменьшением перфузии, что в сочетании с вызываемой апноэ десатурацией теоретически может вызывать гипоксическое повреждение органов. Не установлено достоверно, повышают ли вызываемые апноэ остановки синусового узла риск летального исхода у пациентов с СОАС. Тем не менее, у отдельных больных, в первую очередь при наличии сопутствующих сердечно-сосудистых заболеваний, такой механизм внезапной смерти во время сна представляется потенциально возможным [14].
Синусовые паузы, наблюдающиеся в ночные часы у пациентов с СОАС, следует отличать от преходящих нарушений АV-проводимости с эпизодами асистолии желудочков, также патогенетически связанных с апноэ сна. Так, мы наблюдали пациента с тяжелой формой СОАС, госпитализированного в кардиологический стационар по поводу постоянной формы фибрилляции предсердий [15]. При суточном мониторировании ЭКГ у него было выявлено 37 R-R пауз с максимальной продолжительностью до 12 секунд, которые возникали исключительно во время сна. После коррекции обструктивного апноэ с помощью аппарата СиПАП при контрольном холтеровском мониторировании ни одной R-R паузы зарегистрировано не было.
Анализируя результаты холтеровского мониторирования, врачи иногда необоснованно принимают провоцируемую апноэ сна брадикардию и синусовые паузы (рисунок 3) за проявления синдрома слабости синусового узла. Избежать подобной диагностической ошибки на практике помогает тот факт, что связанная с обструктивным апноэ брадиаритмия возникает только во время сна, в то время как при бодрствовании страдающие ожирением пациенты с СОАС в большинстве своем склонны к тахикардии, что абсолютно не укладывается в концепцию дисфункции синусового узла. Тем не менее, нередки случаи, когда неправильная трактовка причины подобных нарушений приводит к необоснованной имплантации электрокардиостимулятора. Так, в исследовании S. Garrigue et al. (2007) было продемонстрировано, что у 59% пациентов с искусственным водителем ритма имеется СОАС [16]. Обсуждая полученные результаты, авторы делают заключение, что, по всей видимости, не у всех этих больных исходно имевшиеся брадиаритмии были напрямую связаны с апноэ сна, но у потенциальных кандидатов на имплантацию электрокардиостимулятора следует по умолчанию исключать СОАС.
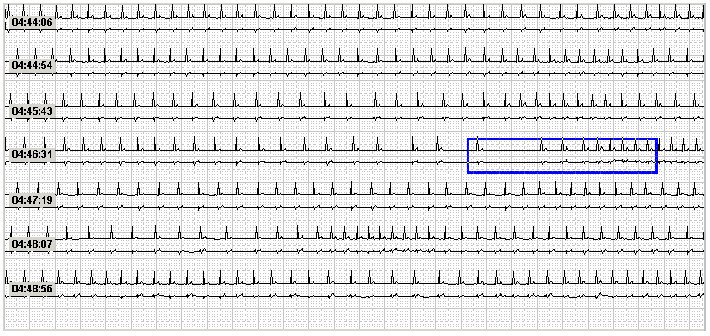
Рисунок 3. Холтеровское мониторирование у пациента с тяжелым СОАС – связанная с эпизодами обструктивного апноэ синусовая аритмия во время сна
Данные о высокой распространенности СОАС среди пациентов с уже имплантированным искусственным водителем ритма послужили основанием к разработке специальной диагностической методики, позволяющей выявлять нарушения дыхания во время сна у больных с электрокардиостимулятором. Для этих целей используется встроенный в ряд современных устройств сенсор, оценивающий минутную вентиляцию легких на основании измерения трансторакального импеданса, что изначально задумывалось как способ адаптации частоты сердечных сокращений к возрастающим метаболическим потребностям пациента. При прекращении или значительном уменьшении вентиляции легких это находит свое отражение на кривой трансторакального импеданса, что в значительной степени коррелирует с результатами, получаемыми при прямой регистрации воздушного потока через верхние дыхательные пути (рисунок 4). Таким образом, речь идет не столько о новой технологии, сколько о разработке и адаптации программного обеспечения под уже имеющиеся возможности современных электрокардиостимуляторов.
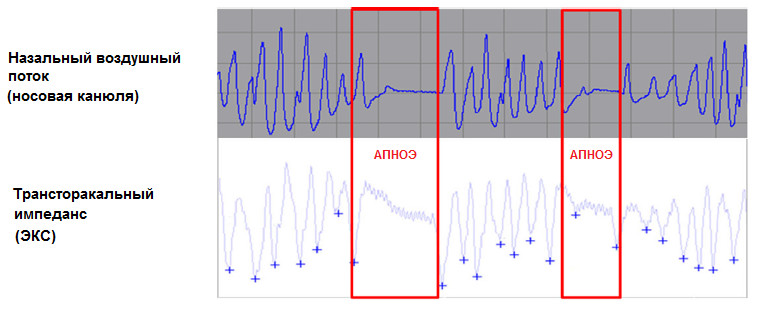
Рисунок 4. Отсутствие изменений трансторакального импеданса при прекращении легочной вентиляции позволяет зафиксировать эпизоды апноэ [Defaye P.et al., 2014].
По данным Defaye P.et al. (2014) чувствительность предлагаемого метода составляет 89%, а специфичность 85%, что в целом совпадает с результатами других исследователей, изучавших аналогичные диагностические алгоритмы [17]. На сегодняшний день основным недостатком этого способа длительного мониторирования дыхания с помощью электрокардиостимулятора является неспособность данных устройств различать обструктивные и центральные нарушения дыхания. С учетом достаточно широкой распространенности синдрома центрального апноэ сна среди пациентов с тяжелой сердечно-сосудистой патологией, потенциальная возможность дифференциальной диагностики этих патологических состояний представляется нам клинически значимой. Об этом же говорят и сами авторы исследований, полагая, что подобная опция будет присутствовать в водителях ритма следующего поколения. Тем не менее, данная диагностическая методика может быть весьма полезна для скринирования и динамического наблюдения за пациентами с уже установленным искусственным водителем сердечного ритма и потенциально возможными нарушениями дыхания во время сна.
Выявляемые у ряда пациентов СОАС при холтеровском мониторировании значительные, циклически повторяющиеся колебания частоты сердечных сокращений во время сна бывают столь характерны, что позволяют говорить о вероятном диагнозе обструктивного апноэ сна. Однако следует помнить, что у части больных явления синусовой дыхательной аритмии могут быть выражены столь незначительно, что оказываются практически неразличимы визуально или, реже, вообще отсутствуют.
В ряде исследований показано, что алгоритмы автоматического анализа результатов холтеровского мониторирования, основывающиеся на оценке вариабельности частоты сердечных сокращений и выявлении характерных для пациентов с сонным апноэ эпизодов брадитахикардии во время сна, позволяют не только оценить вероятность последующего выявления обструктивных нарушений дыхания во время сна, но и достаточно точно определить их тяжесть [18; 19]. Основным ограничением таких разработок является их ориентированность на пациентов с синусовым ритмом. Кроме того, не вполне ясно в какой степени может оказать влияние на результаты подобного тестирования прием лекарственных препаратов, например – бета-блокаторов, способных изменять вегетативные реакции со стороны сердечно-сосудистой системы и контролировать частоту сердечных сокращений у пациентов с СОАС [20].
Тем не менее, на сегодняшний день ряд производителей оборудования для холтеровского мониторирования по умолчанию включают в поставляемое ими программное обеспечение особую опцию, предназначенную для диагностики СОАС и количественной оценки его тяжести. Наш практический опыт показывает, что данные программные продукты пока далеки от совершенства. Полученные с их помощью результаты не следует игнорировать, особенно когда речь идет о вероятном наличии тяжелых нарушений дыхания во время сна. Однако следует понимать, что диагностические возможности подобных систем не выходят за рамки простейшего скрининга, и их не следует рассматривать в качестве независимого и объективного метода выявления СОАС. И, конечно же, они, как и любые другие результаты автоматической расшифровки результатов исследования, не должны подменять собой анализ полученных данных грамотным клиницистом.
В целом ряде исследований показано, что фибрилляции предсердий у пациентов с СОАС наблюдается существенно чаще, чем в сравнимых контрольных группах [10]. С другой стороны, распространенность СОАС у больных с фибрилляцией и трепетанием предсердий высока и по данным ряда авторов достигает 49%, превышая таковую среди пациентов с другими сердечно-сосудистыми заболеваниями [21].
В исследовании Gami A.S. et al. (2007) авторы наблюдали группу из 3542 пациентов, в среднем, в течении 4.7 лет. За это время фибрилляция предсердий развилась у достоверно большего числа пациентов с СОАС по сравнению с контрольной группой – 4.3% и 2.1% соответственно. Авторы сделали заключение, что в группе пациентов младше 65 лет обструктивное апноэ независимо повышает риск возникновения фибрилляции предсердий в 2.2 раза. При этом исследователи приходят к заключению, что тяжесть ночной десатурации наряду с индексом апноэ-гипопноэ является независимым предиктором возникновения фибрилляции предсердий у пациентов с СОАС [22].
Также крайне важным с практической точки зрения является тот факт, что обструктивное апноэ значимо понижает потенциальную эффективность медикаментозной антиаритмической терапии и повышает риск рецидива фибрилляции предсердий после проведения радиочастотной абляции. Так, Matiello M. et al. (2010) установили, что тяжесть СОАС является независимым предиктором возобновления фибрилляции предсердий – по данным авторов, вероятность рецидива при тяжелом СОАС составила 86% по сравнению с 52% у пациентов без апноэ сна [23]. При этом Fein A.S. et al. (2013) показали, что эффективное лечение СОАС в 2 раза уменьшает вероятность возобновления фибрилляции предсердий после проведения радиочастотной абляции [24].
Проанализировав результаты 5 исследований, включавших наблюдение за 3743 пациентами, Li L. et al. (2014) делают заключение, что СОАС в 2 раза повышает риск рецидива фибрилляции предсердий после проведения радиочастотной абляции, в то время как адекватная терапия апноэ сна делает потенциальный риск рецидива идентичным таковому у пациентов, исходно не имевших нарушений дыхания во время сна [25].
Ответ на вопрос о наличии причинно-следственной связи между СОАС и желудочковыми нарушениями ритма представляется не столь однозначным. Так, Mehra R. et al. (2006) выявили значительно большую частоту желудочковой экстрасистолии и неустойчивой желудочковой тахикардии у пациентов с сонным апноэ [10]. В итоге проведенного
Fichter J. et al. (2002) исследования авторы также приходят к заключению, что тяжесть СОАС в значительной мере является определяющей для возникновения желудочковых нарушений ритма преимущественно во время ночного сна [26]. Bitter T. et al (2014) показали, что у пациентов с имплантированным кардиовертером-дифибриллятлором при наличии СОАС срабатывания устройства приходятся преимущественно на время сна, что, по мнению исследователей, косвенно свидетельствует о патогенетической роли обструктивного апноэ в происхождении желудочковых аритмий [27].
Напротив, Grimm W. et al (2013) пришли к заключению, что частота срабатываний кардиовертера-дифибриллятлора не зависит от наличия или тяжести СОАС [28], а, значит, связь между апноэ сна и желудочковыми нарушениями ритма отсутствует.
Столь же неоднозначными выглядят результаты работ, посвященных влиянию терапии СОАС на желудочковые аритмии. В то время как одни авторы сообщают об уменьшении или даже исчезновении желудочковых нарушений ритма при эффективном лечении СОАС [29], другие исследователи не находят значимых изменений в состоянии таких пациентов после нормализации дыхания во время сна [30].
Систематизируя имеющиеся в литературе данные, Bitter T. et al (2015) высказывают предположение, что различия в полученных авторами результатах во многом связаны с избранным дизайном исследований и вопрос о потенциальной связи СОАС и желудочковых аритмий требует дальнейшего изучения [4].
На сегодняшний день накоплен достаточный массив данных о СОАС как факторе риска сердечно-сосудистой смертности. Так, Ge X. et al. (2013) проанализировали результаты
6 проспективных исследований, включавших в общей сложности 11932 пациента, посвященных влиянию СОАС на смертность. Авторы мета-анализа пришли к заключению, что апноэ сна является независимым предиктором сердечно-сосудистой смертности, причем риск летального исхода возрастает пропорционально тяжести нарушений дыхания во время сна. Напротив, у пациентов, получающих адекватное лечение СОАС, сердечно-сосудистые риски остаются такими же, как у лиц, не страдающих апноэ сна [31]. В большинстве рассматриваемых работ основной акцент делался на связи апноэ сна с инфарктом миокарда и инсультом. Однако не исключено, что именно провоцируемая апноэ сна фибрилляция предсердий может быть ответственна за часть смертей от острого нарушения мозгового кровообращения у больных с СОАС.
В связи с обсуждаемой нами темой весьма интересными представляются результаты исследования, проведенного Gami A.S. et al. (2013). В ходе длительного наблюдения за группой из 10701 пациента авторы пришли к заключению, что СОАС является независимым фактором риска внезапной смерти, причем этот риск обусловлен различными параметрами, характеризующими тяжесть апноэ сна, такими как индекс апноэ-гипопноэ и тяжесть гипоксемии во время сна [32]. Этими же авторами показано, что вероятность внезапной кардиальной смерти во сне при наличии СОАС возрастает в 2.6 раза – 46% ночных смертей у пациентов с апноэ сна и только 16% при отсутствии нарушений дыхания во время сна [33]. Возможно, что именно нарушения сердечного ритма являются у больных с СОАС одной из причин внезапной смерти, хотя последнее предположение относится к разряду насколько вероятных, настолько и трудно доказуемых гипотез.
Таким образом, СОАС часто сопровождается различными нарушениями сердечного ритма и является их самостоятельной причиной. Вероятность возникновения ассоциированных с апноэ сна аритмий возрастает пропорционально величине индекса апноэ-гипопноэ и тяжести развивающейся гипоксемии [34]. Соответственно, обструктивное апноэ следует исключать у любого пациента с сердечными аритмиями, если те регистрируются преимущественно во время сна и рефрактерны к традиционной терапии.
СОАС повышает риск сердечно-сосудистой смерти, в том числе внезапной. Вклад вызываемых апноэ сна аритмий в этот рост смертности не доказан окончательно, но весьма вероятен. Коррекция СОАС может оказать одновременный противоаритмический эффект, позволяя в ряде случаев устранить ночные нарушения ритма и улучшить прогноз в отношении опасных последствий имеющейся сердечно-сосудистой патологии. Все это должно учитываться врачами в их повседневной клинической практике.
ЛИТЕРАТУРА:
- Пальман А. Д., Чуранов А. Л., Лишута А. С. и соавт. Синдром обструктивного апноэ во сне у больных терапевтического стационара: клинико-эпидемиологическое исследование // Клиническая геронтология. 2001. №12. С. 15-18.
- Rossi V. A., Stradling, Kohler M. Effects of obstructive sleep apnoea on heart rhythm // Eur. Respir. J. 2013. Vol.41. P.1439-1451.
- Cintra F.D., Leite R.P., Storti L.J. et al. Sleep Apnea and Nocturnal Cardiac Arrhythmia: A Populational Study // Arq. Bras. Cardiol. 2014. Vol.103. P.368-374.
- Bitter T., Fox H., Gaddam S. et al. Sleep-Disordered Breathing and Cardiac Arrhythmias // Can. J. Cardiol. 2015. Vol.31. P.928-9834.
- Solin P., Kaye D.M., Little P.J. et al. Impact of sleep apnea on sympathetic nervous system activity in heart failure // Chest. 2003. Vol.123. P.1119-1126.
- Ан Г. В., Пальман А. Д., Даниляк И. Г., Коган А. Х. Синдром обструктивного апноэ во сне: особенности свободнорадикальных процессов // Вестник новых медицинских технологий. 2000. №1. С.67-68.
- Пальман А. Д., Думикян А. Ш., Хмелькова Е. В. Нарушения ритма сердца у больных с синдромом обструктивного апноэ во сне // Актуальные проблемы сомнологии: Тезисы докладов 2-ой Всероссийской конференции. М., 2000. С.70.
- Somers V.K., Dyken M.E., Skinner J.L. Autonomic and hemodynamic responses and interactions during the Mueller maneuver in humans // J. Auton. Nerv. Syst. 1993. Vol.44. P.2530-259.
- Chan K.H., Wilcox I. Obstructive sleep apnea: novel trigger and potential therapeutic target for cardiac arrhythmias // Expert. Rev. Cardiovasc. Ther. 2010. Vol.8. P.981-994.
- Mehra R., Benjamin E.J., Shahar E. et al. Association of nocturnal arrhythmias with sleep-disordered breathing: The Sleep Heart Health Study // Am. J. Respir. Crit. Care Med. 2006. Vol.173. P.910-916.
- Zwillich C., Devlin T., White D. et al. Bradycardia during sleep apnea. Characteristics and mechanism // J. Clin. Invest. 1982. Vol.69. P.1286-1292.
- Морман Д., Хеллер Л. Физиология сердечно-сосудистой системы. СпБ.: Питер, 2000. 256 c.
- Hanly P., George C., Millar T., Kryger M. Heart rate response to breath-hold, Valsalva and Mueller maneuvers in obstructive sleep apnea // Chest. 1989. Vol.95. P.735-739.
- Калинкин А.Л. Остановка синусового узла в результате апноэ сна, как вероятная причина внезапной смерти во время сна // Функциональная диагностика. 2005. №2. С.73-77.
- Пальман А. Д., Сучкова С. А., Плаксина Н. А. Случай эффективной коррекции нарушений проводимости, связанных с синдромом обструктивного апноэ во сне // Актуальные вопросы внутренней медицины и педагогики. М.: Русский врач, 2002. С.227-231.
- Garrigue S., Pepin J.L., Defaye P. et al. High prevalence of sleep apnea syndrome in patients with long-term pacing: the European Multicenter Polysomnographic Study // Circulation. 2007. Vol.115. P.1703-1709.
- Defaye P., de la Cruz I., Martí-Almor J. et al. Pacemaker transthoracic impedance sensor with an advanced algorithm to identify severe sleep apnea: The DREAM European study // Heart Rhythm. 2014. Vol.11. P.842-848.
- Heneghan C., de Chazal P., Ryan S. et al. Electrocardiogram Recording as a Screening Tool for Sleep Disordered Breathing // J. Clin. Sleep Med. 2008. Vol.4. P.223-228.
- Hayano J., Watanabe E., Saito Y. et al. Screening for Obstructive Sleep Apnea by Cyclic Variation of Heart Rate // Circ. Arrhythm. Electrophysiol. 2011. Vol.4. Р.64-72.
- Wolf J., Drozdowski J., Czechowicz K. et al. Effect of beta-blocker therapy on heart rate response in patients with hypertension and newly diagnosed untreated obstructive sleep apnea syndrome // Int. J. Cardiol. 2015. Vol.202. P.67-72.
- Gami A.S., Pressman G., Caples S.M. et al. Association of atrial fibrillation and obstructive sleep apnea // Circulation. 2004. Vol.110. P.364-367.
- Gami A.S., Hodge D.O., Herges R.M. et al. Obstructive sleep apnea, obesity and the risk of incident atrial fibrillation // J. Am. Coll. Cardiol. 2007. Vol.49. P.565-571.
- Matiello M., Nadal M., Tamborero D. et al. Low efficacy of atrial fibrillation ablation in severe obstructive sleep apnoea patients // Europace. 2010. Vol.12. P.1084-1089.
- Fein A.S., Shvilkin A., Shah D. et al. Treatment of obstructive sleep apnea reduces the risk of atrial fibrillation recurrence after catheter ablation // J. Am. Coll. Cardiol. 2013. Vol.62. P.300-305.
- Li L., Wang Z.W., Li J. et al. Efficacy of catheter ablation of atrial fibrillation in patients with obstructive sleep apnoea with and without continuous positive airway pressure treatment: a meta-analysis of observational studies // Europace. 2014. Vol.16. P.1309-1314.
- Fichter J., Bauer D., Arampatzis S. et al. Sleep-related breathing disorders are associated with ventricular arrhythmias in patients with an implantable cardioverter-defibrillator // Chest. 2002. Vol.122. P.558-561.
- Bitter T., Fox H., Dimitriadis Z. et al. Circadian variation of defibrillator shocks in patients with chronic heart failure: the impact of Cheyne-Stokes respiration and obstructive sleep apnea // Int. J. Cardiol. 2014.Vol.176. P.1033-1035.
- Grimm W., Apelt S., Timmesfeld N., Koehler U. Sleep-disordered breathing in patients with implantable cardioverter-defibrillator // Europace. 2013 Vol.15. P.515-522.
- Harbison J., O’Reilly P., McNicholas W.T. Cardiac rhythm disturbances in the obstructive sleep apnea syndrome: effects of nasal continuous positive airway pressure therapy // Chest. 2000. Vol.118. P. 591-595.
- Craig S., Pepperell J.C., Kohler M. et al. Continuous positive airway pressure treatment for obstructive sleep apnoea reduces resting heart rate but does not affect dysrhythmias: a randomized controlled trial // J. Sleep. Res. 2009. Vol. 18. P.329-336.
- Ge X., Han F., Huang Y. et al. Is obstructive sleep apnea associated with cardiovascular and all-cause mortality? // PLoS One. 2013. Vol.8. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0069432 – электронный документ по состоянию на 19.11.2015.
- Gami A.S., Olson E.J., Shen W.K. et al. Obstructive sleep apnea and the risk of sudden cardiac death: a longitudinal study of 10701 adults // J. Am. Coll. Cardiol. 2013. Vol. 62. P.610-616.
- Gami A.S., Howard D.E., Olson E.J., Somers V.K. Day-night pattern of sudden death in obstructive sleep apnea // N. Engl. J. Med. 2005. Vol. 12. P.1206-1214.
- Белов А.М., Воронин И.М., Захаров В.Н., Горенкова М.Н. Обструктивные нарушения дыхания во время сна и нарушения сердечного ритма // Терапевтический архив. 2004. №3. С.55-59.
